Gastro-entérologie
Rectocolite hémorragique résistante : rémission sous CAR-T cells anti-CD19
Chez une femme de 21 ans atteinte d’une rectocolite hémorragique sévère multirésistante, la perfusion de CAR-T cells anti-CD19 a induit une rémission clinique, biologique et endoscopique en quatorze semaines, sans traitement concomitant. Ce résultat, obtenu par une déplétion profonde sanguine et tissulaire des lymphocytes B et des plasmablastes, rebat les cartes d’une maladie longtemps envisagée comme principalement T-dépendante.
- Nemes Laszlo/istock
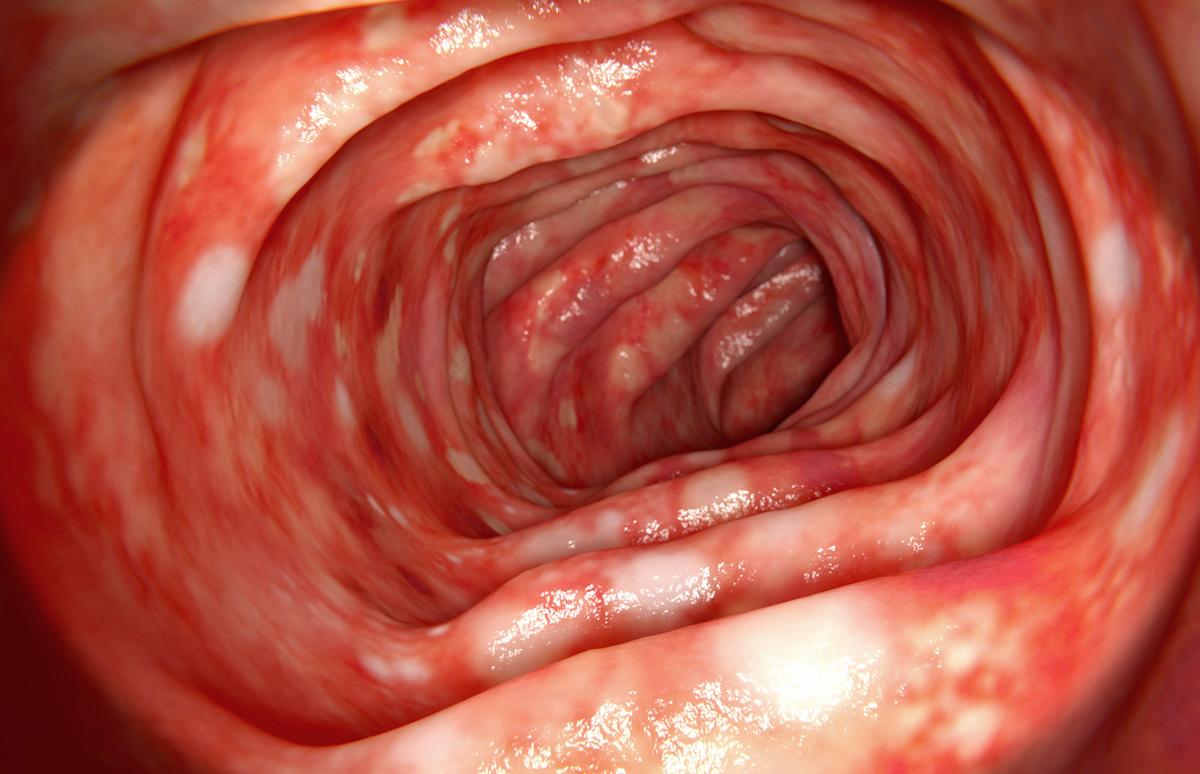
La rectocolite hémorragique est une maladie inflammatoire chronique du côlon à médiation immunitaire, caractérisée par une infiltration muqueuse mêlant cellules adaptatives (T, B, plasmablastes) et innées (neutrophiles, macrophages). Malgré l’arsenal de thérapies ciblées comme les anti-intégrines, les anti-cytokines, les inhibiteurs de JAK, les modulateurs du trafic lymphocytaire, un contingent substantiel de patients reste non-répondeur, avec douleurs, rectorragies, altération de la qualité de vie et risque accru de complications. Le cas présenté concerne une patiente de 21 ans en échec de multiples lignes de traitement, incluant corticothérapie, aminosalicylés, anticorps monoclonaux et inhibiteurs de JAK ou de S1P, ainsi qu’une association cyclosporine-mirikizumab, sans obtention de rémission et refusant la chirurgie.
Une tentative de ciblage B initial avec blinatumomab n’a apporté qu’un bénéfice transitoire, sans déplétion durable des cellules B sanguines et coliques ni réduction des anticorps anti-intégrine αvβ6. Après lymphodéplétion standard, une dose de 1×10^6 cellules/kg de CAR-T cells anti-CD19 autologues a été perfusée. Les CAR-T cells se sont rapidement développés, entraînant une déplétion périphérique et muqueuse des lymphocytes B, puis une rémission clinique et biologique soutenue en quatorze semaines sans traitement associé, corroborée par une cicatrisation muqueuse endoscopique, histologique et ultrasonographique. La reprise pondérale de 9 kg et la reprise d’activité professionnelle soulignent le bénéfice fonctionnel. Ce cas clinique est publié dans le New England Journal of Medicine.
Importance d’un axe B-dépendant dans la colite ulcéreuse
Ce résultat met en lumière l’importance d’un axe B-dépendant dans la rectocolite hémorragique. Les CAR-T cells anti-CD19 induisent une déplétion profonde des lymphocytes B et des plasmablastes jusque dans les compartiments tissulaires, dépassant le champ d’action des anticorps circulants ou des lymphocytes T engageurs dont l’effet peut rester incomplet au niveau muqueux. La dynamique clinique s’accompagne d’arguments biologiques convergents : baisse des IgA sécrétoires fécales, disparition des anticorps sériques anti-intégrine αvβ6, normalisation des marqueurs inflammatoires.
Sur le plan de la tolérance, elle est favorable avec un syndrome de libération de cytokines grade 1, spontanément résolutif, une hypogammaglobulinémie asymptomatique et un épisode isolé de neutropénie corrigé par une injection unique de G-CSF. La comparaison implicite avec l’inefficacité rapportée du rituximab suggère que la profondeur de la déplétion B, incluant le réservoir muqueux et les plasmablastes, constitue un déterminant majeur de l’effet clinique, là où une simple déplétion périphérique ne suffirait pas. Ce signal, bien que limité à une observation, repositionne les lymphocytes B comme cibles thérapeutiques pertinentes dans une pathologie traditionnellement cadrée par les approches anti-lymphocytes T et anti-cytokines.
Une stratégie de rescue par déplétion B intensifiée par CAR-T cells anti-CD19
Pour les cliniciens, ce cas invite à envisager, dans des formes sévères réfractaires refusant ou différant la chirurgie, une stratégie de déplétion B intensifiée par CAR-T anti-CD19 au sein de centres experts et de protocoles encadrés. La sélection des candidates et candidats pourrait à terme s’appuyer sur des biomarqueurs B-dépendants tels que la présence d’anticorps anti-αvβ6, des signatures plasmablastiques et des profils d’IgA muqueuses. La trajectoire de soins doit intégrer la prévention et la surveillance des complications immunologiques et infectieuses : évaluation préthérapeutique, mise à jour vaccinale idéalement avant lymphodéplétion, suivi des immunoglobulines, de la reconstitution lymphocytaire B et des cytopénies, ainsi qu’un monitoring rapproché clinique et endoscopique de la cicatrisation.
Selon les auteurs, l’indication demeure expérimentale et ne saurait être extrapolée hors essais ou registres précoces. Néanmoins, la démonstration d’une rémission rapide et sans traitement d’entretien, par déplétion lymphocytaire B tissulaire franchissant un seuil d’efficacité absent avec d’autres approches, ouvre une voie de sauvetage potentiellement transformante. Les prochaines étapes consisteront à confirmer la sécurité et l’efficacité dans des séries plus larges, préciser le profil répondeur, définir les modalités de ré-administration ou de transition thérapeutique et articuler cette stratégie avec l’arsenal existant, de manière à personnaliser le parcours des patients les plus difficiles à traiter.