Hématologie
Myélome multiple : l'espoir d'un nouvel anticorps bispécifique
Le talquetamab, un nouvel anticorps bispécifique dirigé contre GPRC5D apporte des résultats prometteurs lors d'un essai clinique chez des patients atteints de myélome multiple en échec de traitement.

- CIPhotos/iStock
Le myélome multiple, un type incurable de cancer de la moelle osseuse, est le deuxième cancer du sang le plus fréquent. En France, en 2018, le nombre estimé de nouveaux cas de myélome multiple et de plasmocytome était de 5.442, selon Santé Publique France.
Cependant, une nouvelle thérapie par anticorps bispécifique anti-GPRC5D, un marqueur spécifique des plasmocytes malins, apporte un espoir : elle s’est révélée efficace chez 73% des patients au cours d'un essai cliniques. Les résultats de cet essai de phase 1/2 ont été publiés dans le New England Journal of Medicine (phase 1) et présentés au congrès 2022 de l'ASH (phase 2).
Pourquoi ce traitement fonctionne mieux que les autres ?
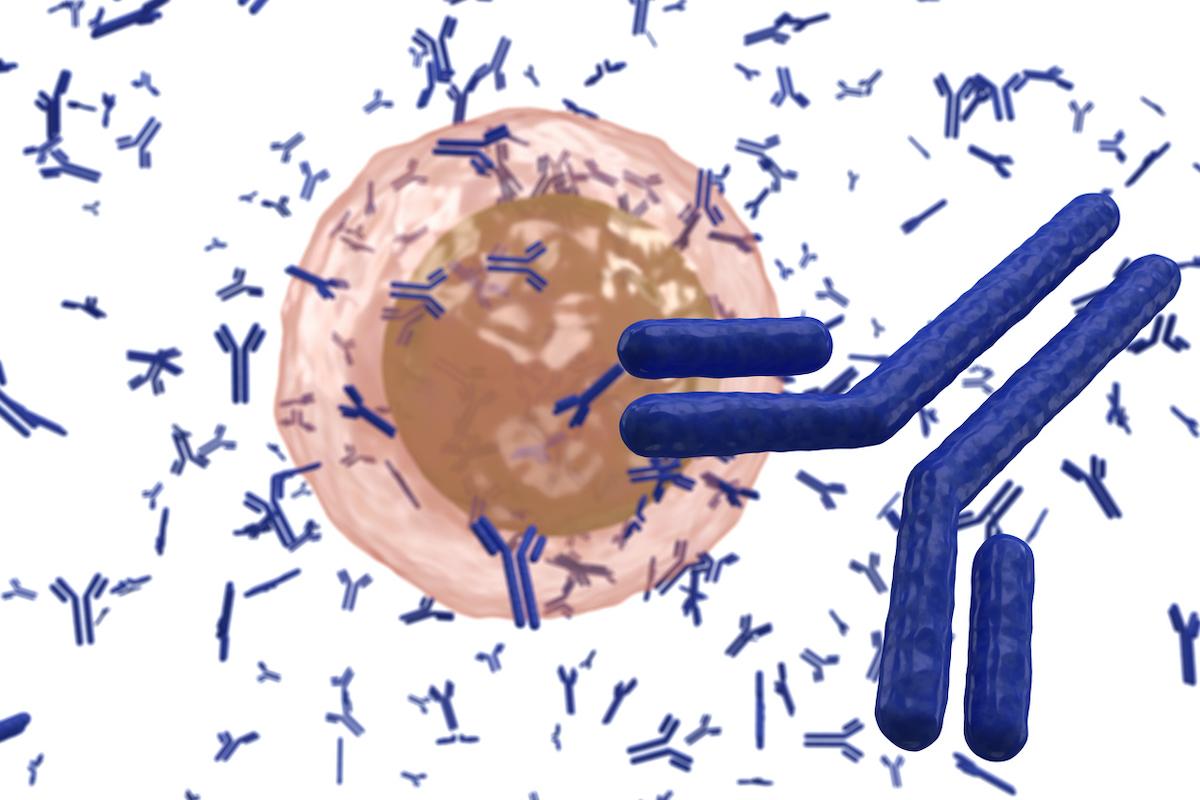
Cette nouvelle thérapie par anticorps bispécifiques agit sur la moelle osseuse du malade en activant son système immunitaire, tuant les cellules cancéreuses. Cela fonctionne en guidant les lymphocytes T pour se fixer aux cellules cancéreuses du myélome se développant dans la moelle osseuse.
L'immunothérapie diffère des traitements précédents du myélome multiple car elle cible un récepteur spécifique, appelé GPRC5D, qui se trouve à la surface des cellules cancéreuses. Cela permet de viser uniquement la partie malade de la moelle osseuse pour la détruire tandis que la partie saine nécessaire au maintien d'un système immunitaire est épargnée.
Le récepteur couplé à la protéine G, famille C, groupe 5, membre D (GPRC5D) est un récepteur orphelin exprimé sur les plasmocytes malins. Le talquetamab, un anticorps bispécifique dirigé contre CD3 et GPRC5D, redirige les lymphocytes T (qui expriment CD3) pour qu'ils tuent les cellules myélomateuses exprimant GPRC5D.
Résultats prometteurs chez des malades déjà lourdement traités
Dans l'étude de phase 1 à doses croissantes publiée dans le NEJM, les taux de réponse chez les patients ayant reçu une médiane de six lignes de traitement antérieures se situaient entre 64% et 70%.
L'étude de phase 2 a recruté des patients qui avaient déjà reçu au moins trois lignes de traitement, dont un inhibiteur du protéasome, un agent immunomodulateur et un anticorps anti-CD38, et dont l'état de performance était bon à moyen.
Le taux de réponse globale (ORR) parmi les patients traités à la dose hebdomadaire de 0,4 mg/kg est de 74,1%, dont 23,8% de réponses complètes strictes (sCR), 9,8% de réponses complètes (CR), 25,9% de très bonnes réponses partielles (VGPR) et 14,7% de réponses partielles (PR).
Le taux de réponse globale (ORR) des patients traités à la dose de 0,8 mg/kg toutes les 2 semaines est de 73,1%, soit 20% de sRC, 12,4% de RC, 24,8% de VGPR et 15,9% de RP. Les taux de réponse sont cohérents dans tous les sous-groupes.
Les durées médianes des réponses sont de 9,3 mois et de 13 mois pour les doses de 0,4 et 0,8 mg/kg, respectivement. La durée médiane de la réponse n'a pas été atteinte chez les patients qui ont obtenu une RC ou mieux dans l'un ou l'autre des groupes de dosage.
"Près de 3/4 des patients atteints de myélome pourraient avoir une nouvelle vie"
Ce qui a marqué les chercheurs, c’est que le succès de ce traitement par anticorps bispécifique est observé chez les patients qui n'avaient pas obtenu de rémission durable avec les traitements précédents (médiane de 6 traitement précédents). Le syndrome de libération de cytokines, les événements cutanés et la dysgueusie sont fréquents lors du traitement par le talquetamab mais sont principalement de faible intensité.
Ces résultats brossent donc un tableau prometteur pour l'avenir de ce nouveau traitement et pour la prise en charge du myélome multiple. "Près des trois quarts de ces patients pourraient envisager une nouvelle vie", a déclaré le Dr Ajai Chari, directeur de la recherche clinique du programme sur le myélome multiple au Tisch Cancer Institute et auteur principal des deux études.