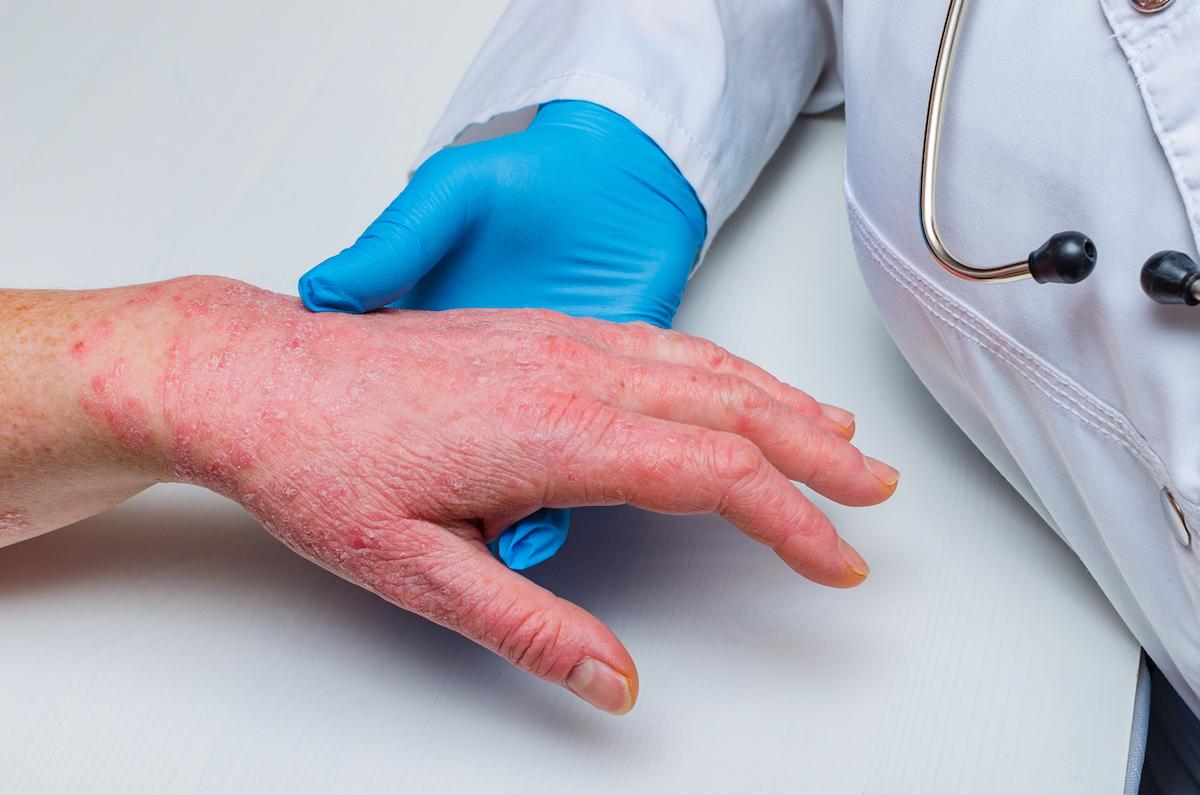
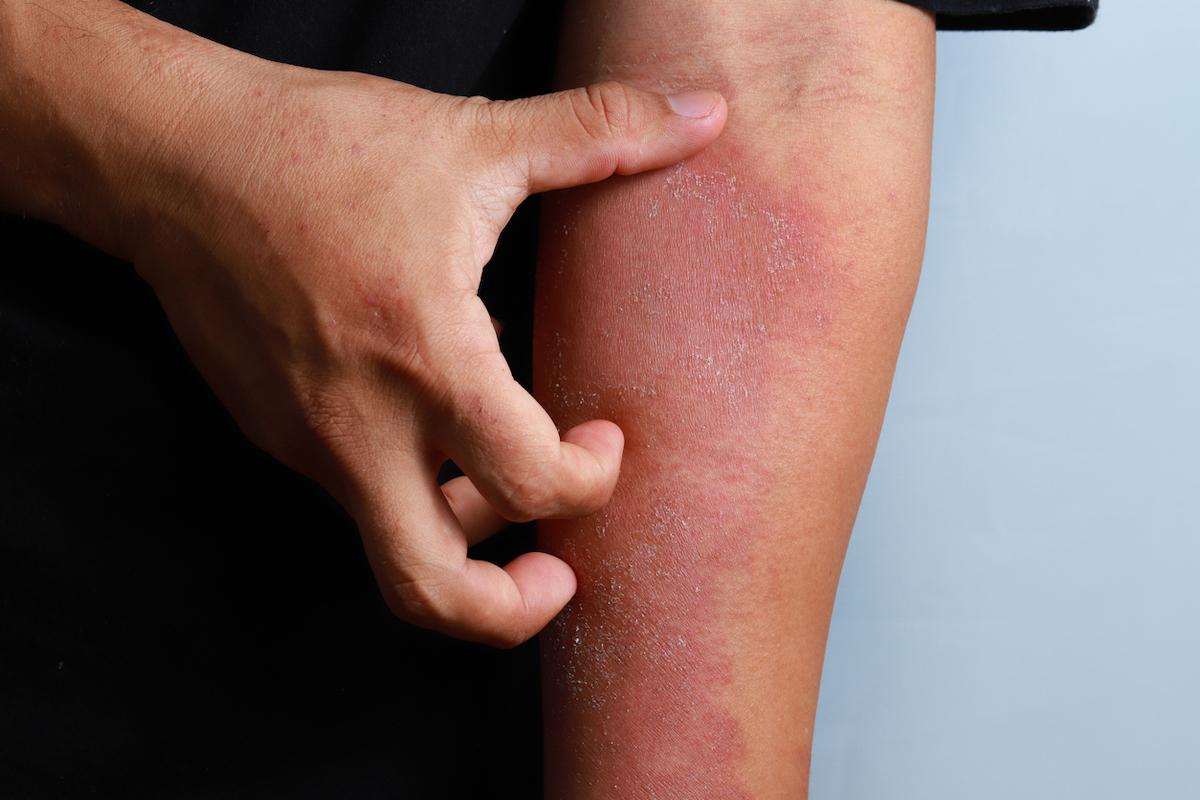
dermatologie
dermatite atopique: l'activité d'un nouvel anticorps monoclonal se prolonge après l'arrêt de l'administration
La publication des essais de phase 3 dans The Lancet menés avec le rocatinlimab confirme dans la prise en charge de la dermatite atopique l’efficacité thérapeutique et la singularité de ce nouvel antcorps monoclonal comparés aux autres traitements disponibles.
- defun/iStock
Les espoirs soulevés par la présentation des essais de phase 2 sont confirmés en ce début d'année 2026 par la publication des essais de phase 3.
Les études ROCKET-IGNITE (IGNITE) et ROCKET-HORIZON (HORIZON), essais de phase 3 randomisés, en double veugle, contrôlés par placebo, d'une durée de 24 semaines, ont été menés dans 19 pays chacun. Les patients éligibles étaient âgés de 18 ans et plus et présentaient une dermatite atopique confirmée (critères de consensus de l'Académie américaine de dermatologie) diagnostiquée au moins un an avant l'inclusion dans l'étude, avec une activité de la maladie modérée à sévère, définie par un score EASI (Eczema Area and Severity Index) ≥ 16, un score vIGA-AD (Investigator's Global Assessment for Atopic Dermatitis) validé de 3 (modérée) ou 4 (sévère), et une surface corporelle atteinte ≥ 10 %. Dans l'étude IGNITE, les patients ont été randomisés selon un ratio 3:2:2 pour recevoir par voie sous-cutanée 300 mg de rocatinlimab, 150 mg de rocatinlimab ou un placebo. Dans l'étude HORIZON, les patients ont été randomisés selon un ratio 3:1 pour recevoir soit 300 mg de rocatinlimab par voie sous-cutanée, soit un placebo. La randomisation a été stratifiée en fonction de la gravité initiale de la maladie (score vIGA-AD de 3 ou 4) et de la région géographique (Japon , pays asiatiques hors Japon ou reste du monde). Dans les deux essais, le traitement de 24 semaines a été administré aux semaines 0, 2 et 4, puis toutes les 4 semaines, la dernière dose étant administrée à la semaine 20. Les critères d'évaluation principaux des deux essais étaient la réponse EASI-75 (amélioration ≥ 75 % du score EASI par rapport à la valeur initiale) à la semaine 24 et un score vIGA-AD de 0 ou 1 (défini comme un score de 0 [peau saine] ou 1 [peau quasi saine], représentant une amélioration ≥ 2 points par rapport à la valeur initiale) à la semaine 24.
Une efficacité confirmée
Les résultats confirment les données observées dans les essaid de phase 2. Entre le 31 mai 2022 et le 12 juin 2024, 769 patients ont été randomisés dans l'étude IGNITE (après la mise à jour du protocole, 328 patients ont été inclus dans le groupe rocatinlimab 300 mg, 217 dans le groupe rocatinlimab 150 mg et 222 dans le groupe placebo). Entre le 14 décembre 2022 et le 12 décembre 2023, 726 patients ont été randomisés dans l'étude HORIZON (543 dans le groupe rocatinlimab 300 mg et 183 dans le groupe placebo). Les deux essais ont atteint leurs critères d'évaluation principaux. Le traitement par rocatinlimab a entraîné des améliorations statistiquement significatives de la réponse EASI-75 par rapport au placebo à la semaine 24 dans les études IGNITE (138 [42 %] des 326 patients sous 300 mg de rocatinlimab ; 78 [36 %] des 215 patients sous 150 mg de rocatinlimab ; et 28 [13 %] des 219 patients sous placebo ; différence en pourcentage par rapport au placebo : 300 mg de rocatinlimab : 29,5 % [IC à 95 % : 22,3–36,1], p < 0,001 et 150 mg de rocatinlimab : 23,4 % [15,4–30,9], p < 0,001) et HORIZON (rocatinlimab : 178 [33 %] des 543 patients contre placebo : 25 [14 %] des 183 patients ; différence en pourcentage : 19,1 % [IC à 95 % : 19,1 %]). 12,4–25,2], p<0,001). Des améliorations statistiquement significatives du score vIGA-AD de 0 ou 1 ont également été observées avec le traitement par rocatinlimab par rapport au placebo à la semaine 24 dans les études IGNITE (77 [24 %] des 326 patients sous rocatinlimab 300 mg ; 41 [19 %] des 215 patients sous rocatinlimab 150 mg ; et 19 [9 %] des 219 patients sous placebo ; différence en pourcentage par rapport au placebo : 14,9 % [IC à 95 % : 8,8–20,6], p < 0,001 pour le rocatinlimab 300 mg et 10,3 % [3,8–16,6], p = 0,002 pour le rocatinlimab 150 mg) et HORIZON (105 [19 %] des 543 patients sous rocatinlimab 300 mg contre 12 [7 %] des 183 patients sous placebo ; différence en pourcentage : 12,8 %). [IC à 95 % : 7,6–17,3], p < 0,001). L’incidence des événements indésirables apparus en cours de traitement était généralement similaire dans les groupes rocatinlimab et placebo des études IGNITE et HORIZON. Les événements indésirables les plus fréquemment rapportés chez les patients recevant du rocatinlimab (définis comme survenant chez ≥ 4 % des patients dans n’importe quel groupe de traitement par rocatinlimab et à une fréquence ≥ 2 fois supérieure à celle observée sous placebo) comprenaient la fièvre (105 [12 %] sur 870 pour la dose de 300 mg de rocatinlimab et 26 [12 %] sur 214 pour la dose de 150 mg de rocatinlimab), les frissons (48 [6 %] sur 870 et 5 [2 %] sur 214 pour les doses de 300 mg et 150 mg, respectivement) et les aphtes (38 [4 %] sur 870 et 6 [3 %] sur 214, respectivement). La plupart des épisodes de fièvre et de frissons ont été considérés comme des réactions liées à l'injection. Ces épisodes étaient généralement d'intensité légère à modérée et survenaient principalement après la première dose. Des événements indésirables graves ont été rapportés chez 2 % à 5 % des patients des groupes rocatinlimab et chez 4 % à 6 % des patients des groupes placebo. Aucun décès n'a été rapporté.
Pourquoi ces résultats soulèvent un nouvel espoir dans la prise en charge de la dermatite atopique? D’abord par le mode d’action original de ce nouvel anticorps monoclonal. Au cours des dernières années, l’arsenal thérapeutique de la dermatite atopique modérée à sévère s’est développé principalement autour de deux grandes stratégies immunologiques : le blocage de cytokines clés de l’inflammation de type 2 et l’inhibition plus large de voies de signalisation intracellulaire.
Le rocatinlimab se distingue de ces approches en ciblant OX40, un récepteur de co-stimulation exprimé par les lymphocytes T activés et mémoire. En bloquant cette voie, le traitement agit plus en amont de la cascade inflammatoire, en réduisant la survie et la persistance des cellules T pathogènes impliquées dans la dermatite atopique.
Un effet clinique se prolongeant après l'arrêt du traitement
Un élément particulièrement original du rocatinlimab est la persistance de l’effet clinique après l’arrêt du traitement, observée chez une proportion importante de patients. Cette caractéristique suggère une modulation durable de la réponse immunitaire plutôt qu’un simple contrôle symptomatique dépendant d’une administration continue. À ce titre, le rocatinlimab pourrait se rapprocher d’une stratégie dite « modificateur de la maladie », ce qui le différencie conceptuellement des traitements actuellement disponibles.
En pratique clinique, le rocatinlimab pourrait trouver sa place chez des patients atteints de dermatite atopique modérée à sévère insuffisamment contrôlée par les traitements topiques, chez lesquels une biothérapie est indiquée, notamment en cas d’échec, d’intolérance ou de réponse incomplète aux anti-IL-4/IL-13, ou chez des patients pour lesquels l’utilisation prolongée d’un inhibiteur de JAK est jugée moins appropriée. Sa capacité potentielle à induire une réponse durable après arrêt du traitement pourrait également intéresser des profils de patients jeunes ou présentant une maladie chronique nécessitant une stratégie thérapeutique à long terme.