Onco-thoracique
Cancer bronchique non à petites cellules : quelles immunothérapies pour quels malades ?
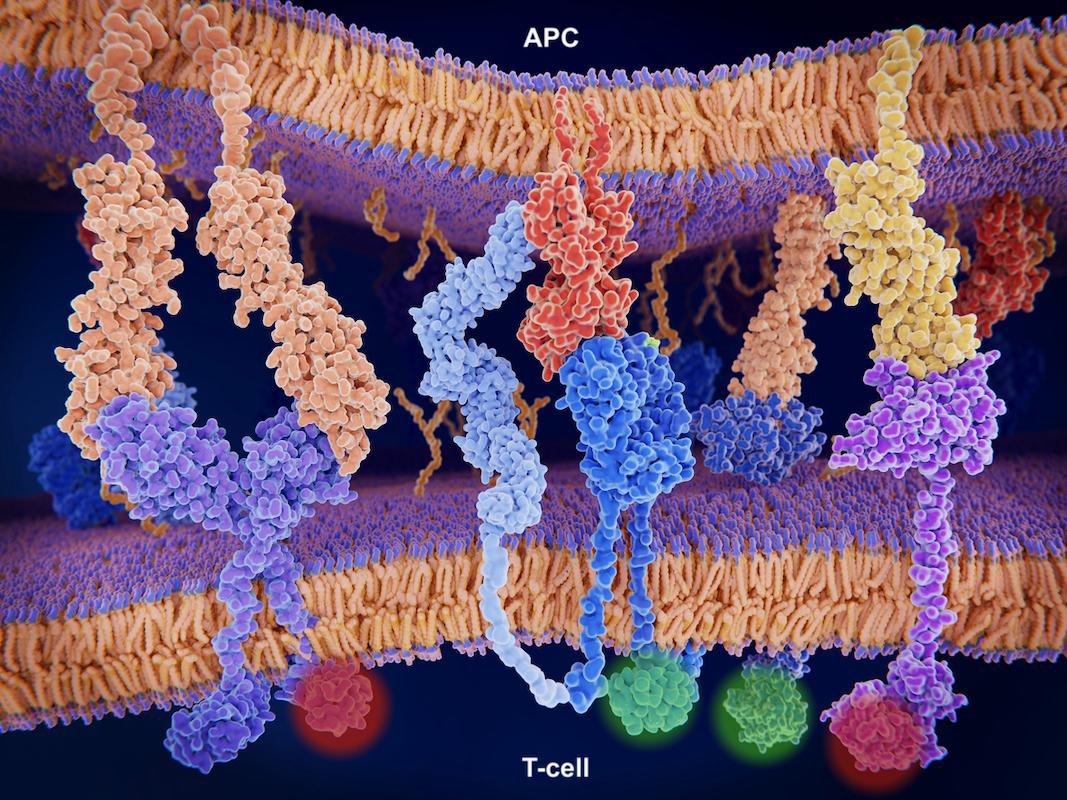
L’immunothérapie est une révolution dans la prise en charge du cancer bronchique non à petites cellules (CBNPC), mais il devient difficile de s‘y retrouver face à l’arrivée des nouvelles immunothérapies en oncologie thoracique, y compris des me-too comme le sugemalimab.
- xrender/istock
L’immunothérapie s’est rapidement installée en première intention dans la prise en charge du cancer bronchique non à petites cellules (CBNPC) depuis les années 2018 avec l’arrivée du durvalumab (anti-PDL1) en consolidation pendant 1 an au stade localement avancé après radio-chimiothérapie concomitante pour un taux de PDL1 ≥ 1% (essai PACIFIC).
Puis, cela a été le Pembrolizumab (anti-PD1) au stade métastatique en association à la chimiothérapie (essai KEYNOTE 189 pour le CBNPC non-épidermoïde et essai KEYNOTE 407 pour le CBNPC épidermoïde) pour tout PDL1 ; ou en monothérapie en 1ère ligne (essai KEYNOTE 024 si PDL1 ≥ 50%).
Et, enfin, dernièrement, au stade localisé, l’immunothérapie a montré son intérêt en termes d’efficacité en situation néoadjuvante avec l’association du nivolumab à la chimiothérapie néoadjuvante pour 3 cycles pour le CBNPC de stade IB à IIIa, ce traitement n’étant actuellement pas remboursé dans cette indication (essai CHECKMATE 816).
Les inhibiteurs de points de contrôle immunitaires se développent de façon rapide dans des indications comparables
Cependant, de nouvelles molécules d’immunothérapie se développent, dans des indications comparables à celles décrites ci-dessus. En prenant l’exemple ici du sugemalimab (anti-PDL1) développée par l’industrie pharmaceutique chinoise, le sugemalimab a montré son intérêt en termes d’efficacité et de tolérance en consolidation pendant 1 an au stade localement avancé après radio-chimiothérapie concomitante ou séquentielle, indépendamment du taux de PDL1 (essai GEMSTONE-301), ainsi qu’au stade métastatique en 1ère ligne en association à la chimiothérapie, quel que soit le sous-type histologique (essai GEMSTONE-302).
Les résultats d’efficacité restent relativement comparables entres les différentes études : l’essai GEMSTONE-301 rapporte une médiane de PFS de 9,0 mois [IC à 95% 8,1–14,1] dans le bras expérimental (sugemalimab en monothérapie pendant 2 ans en consolidation) vs 5·8 mois [95% CI 4·2–6·6] dans le bras placebo, avec un HR=0,64 [IC à 95% 0,48–0,85], p=0,0026 ; l’essai GEMSTONE-302 rapporte une médiane de PFS de 9,0 mois [IC à 95% 7,4–10,8] dans le bras expérimental (association sugemalimab = chimiothérapie adaptée au sous-type histologique) vs 4,9 mois [4,8–5,1]; HR =0,48 [IC à 95% 0,39–0,60], p<0,0001.
Dans l’éventail des immunothérapie (nouveaux anti PD1 : cemiplimab, sintilimab, camrelizumab ; et nouveaux anti PDL1 : sugemalimab) quelle stratégie adopter pour la prise en charge de nos patients ?
Il n’existe malheureusement pas de comparaisons directes de ces molécules entre elles. Des comparaisons indirectes ont déjà été menées. Il existe un réel besoin d’adapter les outils de comparaisons indirectes pour normaliser les comparateurs de ces différentes études (par exemple le bras standard contrôle).
Face à l’arrivée de multiples immunothérapies, cette question devient primordiale dans les années à venir pour améliorer le choix des molécules en fonction du profil du patient et faciliter ainsi la prise en charge des patients atteints de cancer broncho-pulmonaires.