Neurologie
Maladie d’Alzheimer : nouvel échec d’un anticorps anti-amyloïde en prévention
Dans l'étude Alzheimer's Prevention Initiative Study, un anti-amyloïde, le crenezumab, ne permet pas de ralentir ou stopper le déclin cognitif chez les personnes porteuses d'une mutation génétique spécifique à l'origine d’une maladie d'Alzheimer à début précoce. Une remise en cause de la piste amyloïde ?
- Artur Plawgo/istock
Un essai clinique de dix ans, en prévention de la maladie d'Alzheimer, testant l’intérêt du crenezumab, un anticorps anti-amyloïde, ne permettrait pas de ralentir ou stopper le déclin cognitif chez des patients à très haut risque génétique, une nouvelle déception pour la piste thérapeutique consistant à cibler les dépôts d’amyloïde dans le cerveau.
L’Alzheimer’s Prevention Initiative Study est la première étude randomisée portant sur des personnes génétiquement prédestinées à développer la maladie, mais qui n'avaient pas encore de symptômes à l’inclusion, testant un médicament destiné à arrêter ou à retarder le déclin cognitif versus placebo. Les premières données seront présentées officiellement lors de l'Alzheimer's Association International Conference (AAIC) en août 2022.
Un essai de prévention dans la maladie d’Alzheimer
L'essai API ADAD n’objectiverait pas de bénéfice clinique statistiquement significatif sur l'un ou l'autre de ses co-critères primaires, à savoir l’évaluation du taux de changement des capacités cognitives ou de la fonction de mémoire épisodique, mesurés respectivement par le API ADAD composite cognitive score et le Cued Selective Reminding Test (FCSRT) Cueing Index.
De petites différences numériques en faveur du crenezumab sont observées pour le co-critère primaire et les multiples critères secondaires et exploratoires, mais elles ne sont pas statistiquement significatives. Aucun nouveau problème de tolérance ou de sécurité n'a été identifié avec le crenezumab au cours de l'étude malgré une augmentation des doses en cours d’étude.
Des analyses supplémentaires des données sont en cours, en particulier concernant l’IRM et les marqueurs sanguins et seront présentées lors de l'Alzheimer's Association International Conference (AAIC) en août 2022.
Un essai randomisé versus placebo
L'essai API ADAD (NCT01998841) est une étude prospective, randomisée, en double aveugle, contrôlée versus placebo, en groupes parallèles. C’est une étude de phase II testant l'efficacité du crenezumab par rapport au placebo chez des personnes sans déficit cognitif, ni symptômes cliniques de la maladie d'Alzheimer à l’inclusion mais porteuses de la mutation autosomique dominante PSEN1 E280A.
L'essai a recruté 252 membres de la plus grande famille élargie au monde atteinte de la maladie d'Alzheimer en Colombie, et 94% des participants ont terminé l'étude. Deux tiers des participants étaient porteurs de la mutation Presenilin 1 E280A, qui entraîne généralement un déficit cognitif lié à la maladie d'Alzheimer vers l'âge de 44 ans.
Un anticorps monoclonal ciblant les oligomères neurotoxiques
Les participants ont été randomisés pour recevoir soit le crenezumab, un traitement expérimental intervenant dans le mécanisme de constitution des plaques amyloïdes dans le cerveau, ou un placebo pendant cinq à huit ans. Au cours de l'essai, les doses de crenezumab ont été augmentées en fonction de l'évolution des connaissances sur les approches thérapeutiques potentielles de la maladie d'Alzheimer.
Le crenezumab est un anticorps monoclonal expérimental conçu pour neutraliser les oligomères neurotoxiques, une forme de bêta-amyloïde. Le crenezumab possède un squelette d'anticorps (IgG4) conçu pour minimiser la réponse inflammatoire dans le cerveau, ce qui peut entraîner un risque moindre de certaines anomalies IRM connues sous le nom d'ARIA (Amyloid-Related Imaging Abnormalities).
Une population à très haut risque génétique
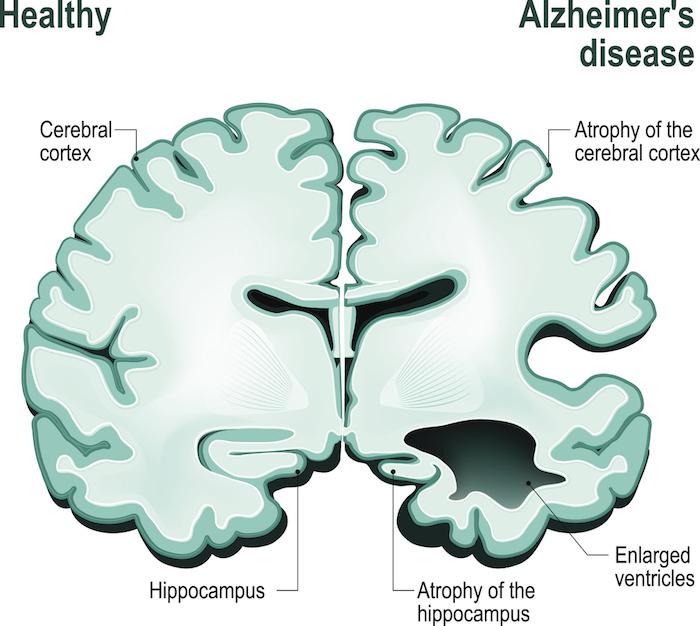
La forme autosomique dominante de la maladie d'Alzheimer (ADAD, aussi connue sous le nom de maladie d’Alzheimer familiale ou dominantly-inherited AD ou DIAD) est une forme rare et héréditaire de la maladie d'Alzheimer causée par des mutations monogéniques dans les gènes APP, PSEN1 ou PSEN2. On pense que moins de 1% de tous les cas de maladie d'Alzheimer dans le monde sont dus à des mutations génétiques.
Chez les porteurs de cette anomalie, la maladie d'Alzheimer se déclare généralement beaucoup plus tôt que dans la forme habituelle de la maladie d'Alzheimer, les symptômes apparaissant chez les personnes âgées de 30 à 60 ans. Si une personne est porteuse d'une de ces mutations, elle est presque certaine de développer la maladie d'Alzheimer et il y a 50% de chances qu'elle la transmette à chacun de ses enfants.
La mutation PSEN1 E280A ou « Paisa », concernée dans cette étude, garantit pratiquement à ses porteurs de développer la maladie d'Alzheimer à un âge moyen de 44 ans et une démence à un âge moyen de 49 ans. Les Colombiens porteurs de la mutation PSEN1 E280A constituent la plus grande famille élargie au monde atteinte de la maladie d'Alzheimer, avec environ 6 000 membres de la famille et environ 1 200 porteurs de la mutation.
Faut-il cibler les plaques amyloïdes ?
Ces résultats constituent un autre revers pour les médicaments qui ciblent une protéine clé de la maladie d'Alzheimer : l'amyloïde, qui forme certaines plaques dans le cerveau des patients atteints de la maladie (à côté de celles liées à la protéine Tau). Des années d'études avec divers médicaments ciblant l'amyloïde, à différents stades de la maladie, ont échoué. En 2019, le laboratoire Roche avait interrompu deux autres essais avec le crenezumab, chez des personnes aux premiers stades de la forme habituelle de la maladie d'Alzheimer, en l’absence de bénéfice apparent.
L'année dernière, dans une décision très controversée, la Food and Drug Administration a accordé sa première approbation à un anticorps anti-amyloïde, l'aducanumab. La FDA a reconnu qu'il n'était pas certain que l'aducanumab puisse aider les patients, mais elle l'avait approuvé dans le cadre d'un programme qui permet d'autoriser des médicaments aux bénéfices incertains s'ils sont destinés à des maladies graves pour lesquelles il existe peu de traitements et s'ils agissent sur un mécanisme biologique raisonnablement susceptible d'aider les patients.
La prévention est désormais considérée comme étant la meilleure façon d’agir contre la maladie d'Alzheimer. L'essai API ADAD est certes négatif, mais cette étude de prévention sur 10 ans a lancé une nouvelle ère dans la recherche sur le traitement de la maladie d'Alzheimer. ON verra ce qu'il en sera avec d'autres molécules, et en particulier les anticorps anti-protéine Tau.