Cardiologie
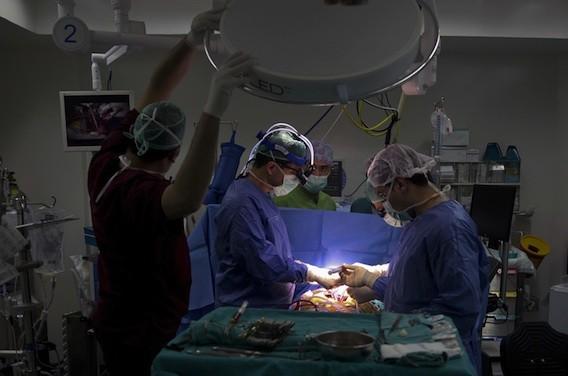
La greffe cardiaque, libérée des contraintes grâce aux innovations à venir
Une vague d'innovations sans précédent serait en train de modifier en profondeur le devenir de la transplatation cardiaque autour de quatre concepts clés selon un article publié dans The European Heart Journal. Explications.

- IaremenkoiStock
Et si la transplantation cardiaque, telle que nous la connnaissons aujourd'hui, n'en était qu'à ses débuts ?
L'article publié dans the European Heart Journal, l’avenir de la thérapie de remplacement cardiaque : quatre frontières de la transformation (Alissa Florian, Andreas Zuckermann, Arezu Aliabadi-Zuckermann) ne constitue pas, insistent ses auteurs, un essai de science fiction mais bien un résumé des innovations déjà programmées dans les laboratoires de recherche.
L’article explore ainsi une vision intégrative et prospective de l’évolution de la thérapie de remplacement cardiaque, vers quatre axes de transformation convergents. Bien qu’elle demeure l’option la plus avancée en matière de remplacement d’organe, la transplantation cardiaque est historiquement limitée par des contraintes biologiques, logistiques et temporelles. Les auteurs mettent en avant une synthèse de technologies émergentes qui redéfinissent non seulement comment remplacer un cœur, mais ce que signifie ce remplacement au sens large.
Plus de contrainte de temps
1) Le temps n’est plus une fatalité : la préservation comme transformation
Traditionnellement, la fenêtre d’ischémie limitée définissait toutes les étapes de la greffe. Les avancées récentes en préservation dynamique (incluant des systèmes de perfusion normothermique ex situ ou hypothermique oxygéné) permettent non seulement d’étendre significativement cette fenêtre au-delà des contraintes géographiques et horaires, mais aussi de modifier biologiquement le greffon avant implantation.
- Les perfusions ex situ offrent désormais la possibilité de réparer ou o
- ptimiser un cœur avant greffe, atténuer les dommages liés à l’ischémie-reperfusion et moduler l’immunogénicité.
- Des stratégies comprenant l’inactivation virale, l’immunomodulation génique locale voire la conversion antigénique sont en cours d’étude, ouvrant la voie à un élargissement du pool de cœurs utilisables.
Ce passage du temps comme contrainte vers une plateforme thérapeutique active constitue une révolution conceptuelle fondamentale.
Un coeur artificiel permanent?
2) Vie mécanique : vers des dispositifs artificiels et hybrides
L’article décrit une deuxième frontière où l’ingénierie mécanique ne se contente plus d’être un simple pont vers la transplantation mais devient une alternative durable et performante :
Les cœurs artificiels de nouvelle génération et dispositifs hybrides intègrent des matériaux biocompatibles, des systèmes adaptatifs de circulation et des capteurs intelligents qui ajustent en temps réel la perfusion en fonction des besoins physiologiques.
Ces machines, à la fois moins thrombogènes et potentiellement auto-régulées, s’approchent ou dépassent certaines fonctions biologiques et proposent des solutions pour les patients non éligibles à une greffe classique.
3) Conception biologique : organes bioingénierés et alternatives
Une troisième frontière est celle des organes créés en laboratoire ou reconfigurés :
- Les approches incluent la xénotransplantation, la décellularisation/repopulation tissulaire, ainsi que l’impression 3D d’organes et des plateformes de génie tissulaire.
- L’objectif est de répondre à l’insuffisance chronique d’organes disponibles et à la variabilité de qualité des greffons humains.
Bien que ce domaine en soit encore aux étapes précliniques ou expérimentales, il représente une alternative potentielle à long terme au modèle donneur-receveur classique.
4) Le système conscient : prédiction, précision et « cœur numérique »
La quatrième frontière est l’intégration des données, de l’intelligence artificielle (IA) et de la médecine personnalisée dans chaque étape du processus :
- Les algorithmes de machine learning améliorent désormais l’évaluation de la qualité d’un cœur donneur en intégrant imagerie, biomarqueurs et profils moléculaires pour prédire la résilience du greffon.
- Des systèmes de correspondance optimisés, dépassant les paramètres classiques (poids, groupe sanguin), permettent d’estimer mieux encore la compatibilité immunologique et les résultats à long terme.
- Des concepts avancés comme jumeaux numériques (digital twins) et des modèles prédictifs intégrant des données multi-omiques visent à individualiser les stratégies de traitement.
De plus, des innovations telles que la libération ciblée d’immunosuppresseurs via nanoparticules sont en développement pour réduire les effets indésirables des thérapies systémiques.
Les auteurs concluent que ces quatre piliers — temps, mécanique, biologie et intelligence — ne sont pas des options concurrentes mais des composantes interconnectées d’un nouveau paradigme. Ils envisagent un avenir où la transplantation cardiaque s’inscrit dans un continuum thérapeutique intégrant des solutions mécaniques, biologiques et numériques, rendant possible une approche plus personnalisée, efficace et accessible.
Cette vision ne réduit pas l’homme à la machine, mais repositionne le cœur au centre d’un écosystème thérapeutique pensé pour s’adapter, anticiper et optimiser chaque étape du remplacement cardiaque.