Pneumologie
Sotatercept dans l’année après le diagnostic de l’hypertension artérielle (HTAP) : résultats de l’essai HYPERION
Le sotatercept, un traitement ciblant la voie du TGF-β, offre une nouvelle voie thérapeutique dans l’hypertension artérielle pulmonaire (HTAP). Ce traitement a déjà montré son efficacité dans l’HTAP dans 2 essais de phase 3 (STELLAR et ZENITH), qui avaient inclus des patients ayant une longue évolution de la maladie (STELLAR) ou ayant une forme sévère de la maladie (ZENITH). Les résultats de l’essai HYPERION, incluant des patients dans l’année après le diagnostic d’HTAP, étaient très attendus. D’après un entretien avec Etienne-Marie JUTANT
L’essai HYPERION, dont les résultats sont parus en septembre 2025 dans le New England Journal of Medicine et ont été présentés au congrès de l’ERS, a évalué l’efficacité et la tolérance du sotatercept chez les patients atteints d’HTAP, diagnostiqués depuis moins d’un an et déjà traités en première ligne depuis au moins trois mois. Les patients inclus étaient en classe NYHA 2 ou 3, et à risque de mortalité intermédiaire ou élevé. Au total, 86 patients ont reçu un traitement par sotatercept, à raison d’une injection sous-cutanée toutes les trois semaines, jusqu’à la dose cible de 0,7mg/kg, et 86 le placebo. A la différence de l’essai STELLAR qui avait comme critère de jugement principal le test de marche de 6 minutes, l’essai HYPERION avait comme critère de jugement principal l’aggravation clinique, correspondant à un critère composite (décès, hospitalisations pour aggravation de l’HTAP, transplantation pulmonaire, dégradation de la capacité d’exercice liée à l’HTAP).
Historique de l’essai HYPERION
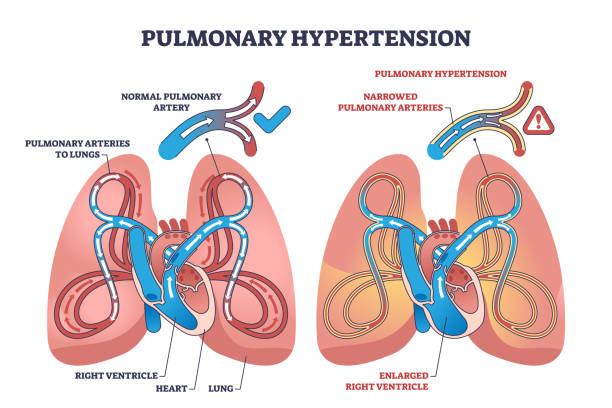
Le professeur Etienne Marie JUTANT, pneumologue au Centre Hospitalier Universitaire de Poitiers, avec une activité de recherche sur l’hypertension pulmonaire, et qui a inclus des patients dans cet essai, rappelle que les traitements de l’HTAP ciblent jusque-là trois voies de la dysfonction endothéliale et améliorent le pronostic mais ne permettent pas encore la guérison. La maladie est due à un remodelage artériolaire pulmonaire qui fait suite notamment à un déséquilibre de la voie du TGF- β avec une perte de fonction de la voie de BMPR2 et une activation de la voie de l’activine. Le rôle du sotatercept est de piéger les ligands des activines, et de rééquilibrer cette balance entre voie de l’activine et voie du BMPR2. On obtient ainsi un effet antiprolifératif sur les cellules vasculaires pulmonaires et un effet positif sur le remodelage artériolaire pulmonaire. Etienne-Marie JUTANT rappelle l’historique des travaux sur le sotatercept avec l’étude de phase 2 PULSAR dont le critère de jugement principal était la réduction des résistances vasculaires pulmonaires, puis l’étude de phase 3 STELLAR dont le critère de jugement principal était l’amélioration du test de marche de 6 minutes. Ces deux essais étaient positifs sur le critère de jugement principal, et montraient des effets positifs sur les critères secondaires de morbi-mortalité. Les effets secondaires étaient la plupart du temps gérables, avec principalement des épistaxis, des télangiectasies, des thrombopénies. L’essai ZENITH a suivi, dont les résultats sont parus début 2025 dans le NEJM, et avait pour objectif d’évaluer l’efficacité du sotatercept chez les patients les plus sévères, déjà sous trithérapie maximale. Cet essai a été interrompu après les analyses intermédiaires en raison d’une amélioration significative du critère de jugement principal (critère composite composé de décès, hospitalisation pour aggravation de l’HTAP et transplantation pulmonaire). L’essai HYPERION a été mené en parallèle.
Un essai positif malgré une interruption de l’étude
Etienne-Marie JUTANT explique que le Comité Directeur a décidé de l’interruption de l’étude HYPERION avant même l’analyse intermédiaire, estimant que, compte-tenu des résultats positifs des trois études précédentes, les données étaient suffisantes et il n’était pas éthique de continuer, en raison de la perte de chance pour le groupe placebo. Malgré cette interruption, cette étude s’est avérée positive sur son critère de jugement principal d’aggravation clinique, avec 10% d’aggravation clinique pour les patients sous sotatercept versus 37% chez les patients sous placebo. Cet effet était tiré principalement par une baisse des hospitalisations et des aggravations de la capacité à l’exercice dans le bras sotatercept. La tolérance du traitement était bonne et les effets indésirables les plus fréquents étaient les épistaxis et les télangiectasies.
Etienne-Marie JUTANT estime que cette nouvelle étude sur le sotatercept ouvre de nouvelles opportunités thérapeutiques dans l’HTAP. La France dispose actuellement d’un accès précoce pour le sotatercept pour les patients en trithérapie restant en classe fonctionnelle 2 ou 3 de la NYHA, , ou encore chez les patients en classe fonctionnelle 4 de la NYHA, en bithérapie et non éligibles à une prostacycline parentérale ou en trithérapie . Le 7ème congrès mondial avait intégré le sotatercept dans l’algorithme thérapeutique et les prochaines recommandations sur l’THAP intégreront certainement le sotatercept de plus en plus tôt dans l’algorithme. Il n’y a cependant pas de données sur le sotatercept en première ligne.
Il précise que dans la cohorte de l’étude HYPERION, la population de patients est plus proche de ce qui existe en vraie vie : ils ont une évolution courte de la maladie, sont plus âgés et ont plus de comorbidités (un tiers étaient obèse, la moitié hypertendue, 20% étaient diabétiques et 10% avaient une coronaropathie). La plupart d’entre eux (72%) étaient sous bithérapie.
En conclusion, l’arrivée d’une nouvelle voie thérapeutique dans une maladie rare est un événement important et cette quatrième étude sur le sotatercept apporte de nouvelles données sur l’efficacité du sotatercept dans la première année du diagnostic et restant en classe fonctionnelle II ou III de la NYHA et en risque intermédiaire ou élevé de mortalité malgré un traitement de première ligne. Les études en vie réelle sur l’efficacité mais aussi sur la tolérance seront à suivre de près car de nouveaux effets indésirables ont été décrits en vraie vie comme des cas d’hypoxémie liée à des shunts ou d’épanchements péricardiques.