Oncologie
Radioligands (RIV) : la médecine nucléaire devient ciblée
Face aux limites historiques de la chimiothérapie et de la radiothérapie externe, une nouvelle arme émerge : les radioligands ou radiothérapie interne vectorisée (RIV). En associant la précision d’un ligand tumoral à la puissance de la radioactivité, ils promettent une médecine nucléaire enfin ciblée. Du diagnostic au traitement, le paradigme change.
- Thomas Hecker/istock
Pendant des décennies, la cancérologie a reposé sur deux grandes approches : la chimiothérapie et la radiothérapie externe. La chimiothérapie agit dans tout l’organisme mais au prix d’une toxicité lourde, détruisant les cellules cancéreuses mais aussi les cellules saines qui se divisent rapidement, comme celles de la moelle osseuse, des muqueuses ou des follicules pileux. La tolérance reste un problème majeur. La radiothérapie externe, de son côté, a beaucoup progressé avec des techniques comme l’IMRT ou la stéréotaxie, mais elle demeure limitée par la localisation anatomique, la proximité d’organes sensibles et la nécessité de marges de sécurité qui exposent inévitablement des tissus sains.
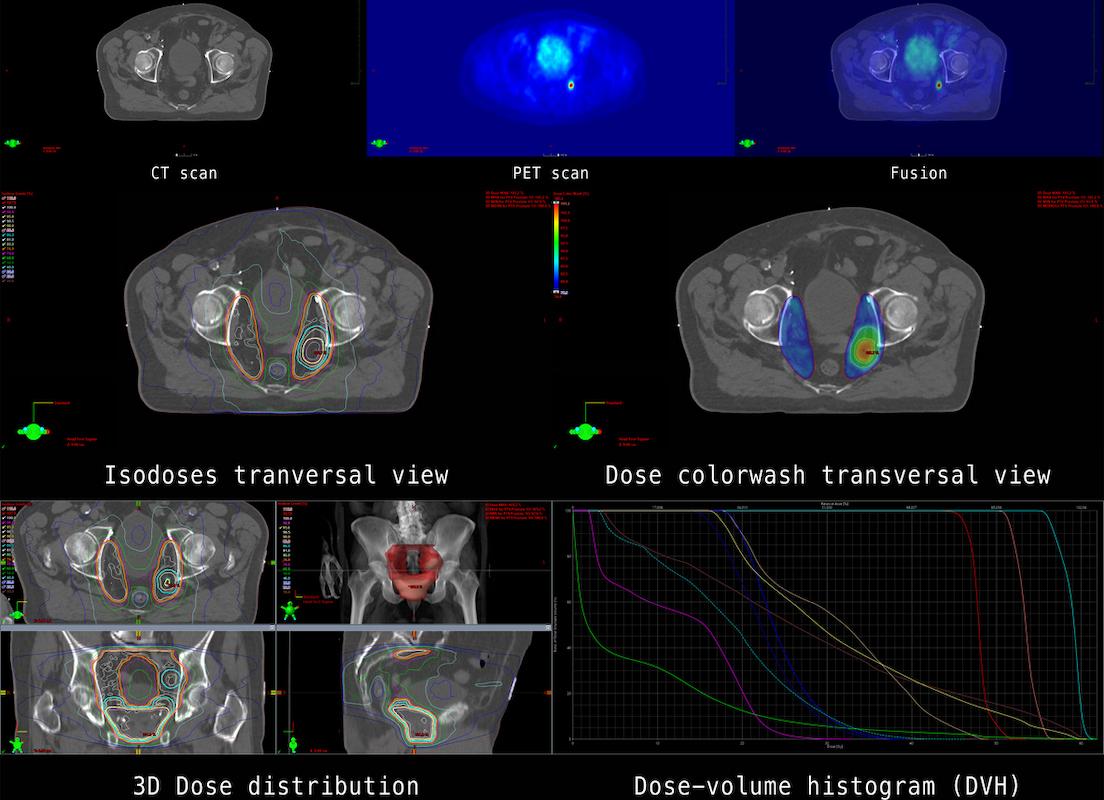
Face à ces limites, un nouvel outil émerge : les radioligands. Ils représentent une évolution majeure car ils combinent la puissance destructrice de la radioactivité et la précision d’un traitement ciblé. Un radioligand associe deux éléments. Le premier est une molécule, ligand ou anticorps, qui reconnaît spécifiquement une cible exprimée à la surface des cellules tumorales. Le second est un isotope radioactif capable d’émettre un rayonnement thérapeutique.
Une fois le ligand fixé à la cellule cancéreuse, la charge radioactive est délivrée directement sur cette cellule, créant une micro-explosion qui détruit la tumeur sans affecter de manière importante les tissus voisins. Cette approche a donné naissance au concept de « théranostic », qui associe dans un même parcours diagnostic et traitement : l’imagerie avec un traceur permet de vérifier que la cible est présente, et si c’est le cas, le même ligand couplé à un isotope thérapeutique peut être administré.
Les isotopes les plus utilisés sont le lutécium 177, qui émet un rayonnement bêta adapté aux applications thérapeutiques, et l’actinium 225, émetteur alpha plus énergique et d’action plus courte, qui promet une sélectivité encore plus grande. Le gallium 68 est utilisé pour l’imagerie et constitue un maillon essentiel de la stratégie théranostique.
Les preuves cliniques sont déjà solides dans deux indications.
Le premier domaine est celui du cancer de la prostate avancé. Les cellules prostatiques tumorales expriment une protéine de surface appelée PSMA. Le radioligand PSMA-617, couplé au lutécium 177, a été évalué dans l’essai VISION publié en 2021.
Plus de 800 patients atteints de cancer de la prostate métastatique résistant à la castration ont été inclus.
Les résultats ont montré une survie globale médiane de 15,3 mois contre 11,3 mois dans le groupe contrôle. La survie sans progression radiologique était de 8,7 mois contre 3,4 mois, et le taux de réponse PSA de 46 pour cent contre 7 pour cent. Ces résultats ont établi le PSMA-617 comme une option thérapeutique validée dans cette population. La tolérance se caractérise par une fatigue, une myélosuppression, des nausées et une sécheresse buccale, mais globalement le profil est plus acceptable que celui d’une chimiothérapie lourde.
Le deuxième domaine validé est celui des tumeurs neuroendocrines. Celles-ci expriment des récepteurs de la somatostatine. Le radioligand OTATATE marqué au lutécium 177, a été testé dans l’essai NETTER-1 publié en 2017 chez 229 patients avec tumeurs neuroendocrines de l’intestin moyen. La survie sans progression médiane n’était pas atteinte dans le bras Dotatate, contre 8,4 mois sous traitement standard. Le taux de réponse objective était de 18 pour cent contre 3 pour cent. La tolérance a été marquée par des nausées, des vomissements et une toxicité hématologique modérée. Ce traitement est désormais approuvé aux États-Unis et en Europe.
Ces résultats démontrent que la RIV augmente la survie globale et la survie sans progression dans des cancers avancés, avec des taux de réponse supérieurs aux approches conventionnelles et une tolérance généralement meilleure que celle des chimiothérapies lourdes. La toxicité hématologique demeure un point de vigilance, mais dans l’ensemble, elle offreune nouvelle arme thérapeutique, notamment pour les situations métastatiques résistantes.
Au-delà de ces deux indications, le pipeline est riche.
Des essais cliniques sont en cours dans le cancer du sein avec des cibles comme HER2 ou le récepteur du peptide libérant la gastrine, dans le cancer du rein avec la cible CAIX, dans les hémopathies malignes avec CD20, CD37 ou BCMA, et même dans le glioblastome. L’utilisation d’émetteurs alpha comme l’actinium 225 est explorée avec des résultats préliminaires encourageants, en particulier dans le cancer de la prostate.
Cette nouvelle génération de radioligand ouvre aussi la voie à des combinaisons thérapeutiques. L’association avec l’hormonothérapie, les inhibiteurs de PARP ou les immunothérapies est déjà testée, avec l’idée de renforcer les réponses et de prolonger leur durée.
Toutefois…
Plusieurs contraintes doivent être soulignées. L’infrastructure nécessaire limite l’accès : seuls les services de médecine nucléaire disposant de radiopharmacies et d’un secteur radioprotégé (chambre ou box d’hôpital de jour) peuvent administrer ces traitements.
La logistique est complexe, car les isotopes ont une durée de vie courte et nécessitent une production et un transport rapides. Le coût est élevé, souvent plusieurs dizaines de milliers d’euros par cure, ce qui soulève des questions de remboursement et d’équité d’accès. Enfin, la sécurité impose une surveillance stricte des soignants, la gestion des déchets radioactifs et des consignes aux proches des patients.
Malgré ces défis, les radioligands marquent une nouvelle étape de la médecine nucléaire. L’innovation est double : une médecine de précision, capable de cibler la cellule tumorale au niveau moléculaire, et une approche théranostique qui combine diagnostic et traitement.
Ce n’est pas une promesse lointaine mais une réalité déjà intégrée dans les recommandations pour la prostate et les tumeurs neuroendocrines.
Les perspectives sont vastes. L’extension à d’autres cancers fréquents est probable si les essais confirment les résultats initiaux. Le développement du théranostic personnalisé pourrait s’imposer comme un standard, avec une imagerie préalable obligatoire pour sélectionner les patients.
Les isotopes alpha pourraient rendre les traitements encore plus puissants et sélectifs. Et les combinaisons avec d’autres thérapies pourraient renforcer leur efficacité.
En pratique, cette innovation change déjà le quotidien.
Dans les RCP, la question se pose désormais : mon patient est-il éligible à un radioligand? Un patient avec prostate métastatique résistant, PSMA positif en TEP, ou une tumeur neuroendocrine exprimant les récepteurs de la somatostatine peut bénéficier d’un traitement qui allonge sa survie et améliore sa qualité de vie. Ce n’est pas une révolution totale mais c’est un changement de paradigme concret.
La RIV n’est plus un concept expérimental : elle est devenue une réalité clinique dans certains cancers avancés.
Elle offre une combinaison unique : le ciblage moléculaire des thérapies biologiques et la puissance destructrice de la radioactivité.
Son développement reste limité par les contraintes logistiques et économiques, mais leur succès dans la prostate et les tumeurs neuroendocrines annonce une nouvelle ère de la médecine nucléaire.
Un quart d’heure d’avance qui, pour certains patients, peut déjà se traduire en mois, voire années, de vie gagnée.
Références
Sartor O, de Bono J, Chi KN, et al. Lutetium-177–PSMA-617 for Metastatic Castration-Resistant Prostate Cancer. N Engl J Med. 2021;385:1091-1103.
Hofman MS, Emmett L, Sandhu S, et al. [177Lu]Lu-PSMA-617 versus cabazitaxel in patients with metastatic castration-resistant prostate cancer (TheraP): a randomised, open-label, phase 2 trial. Lancet. 2021;397(10276):797-804.
Strosberg J, El-Haddad G, Wolin E, et al. Phase 3 Trial of 177Lu-Dotatate for Midgut Neuroendocrine Tumors. N Engl J Med. 2017;376:125-135.
Herrmann K, Schwaiger M, Lewis JS, et al. Radiotheranostics: A Roadmap for Future Development. Lancet Oncol. 2020;21(3):e146-e156.
Morris MJ, De Bono J, Chi KN, et al. PSMA-targeted Radioligand Therapy for Prostate Cancer. Clin Cancer Res. 2021;27(23):6297-6305.
National Comprehensive Cancer Network (NCCN). NCCN Clinical Practice Guidelines in Oncology: Prostate Cancer. Version 1.2024.
Pavel M, Öberg K, Falconi M, et al. ENETS Consensus Guidelines Update for the Management of Distant Metastatic Disease of Intestinal, Pancreatic, Bronchial Neuroendocrine Neoplasms. Neuroendocrinology. 2020;110:227-250.





























