Pédiatrie
Virus Respiratoire Syncytial : un anticorps en préexposition protège les nourrissons
Le nirsevimab, un anticorps monoclonal anti-VRS en dose unique pré-exposition, protège significativement les nourrissons contre les infections à virus respiratoire syncytial (VRS) pendant toute la durée de la saison de circulation du virus.
- Narongrit Sritana/istock
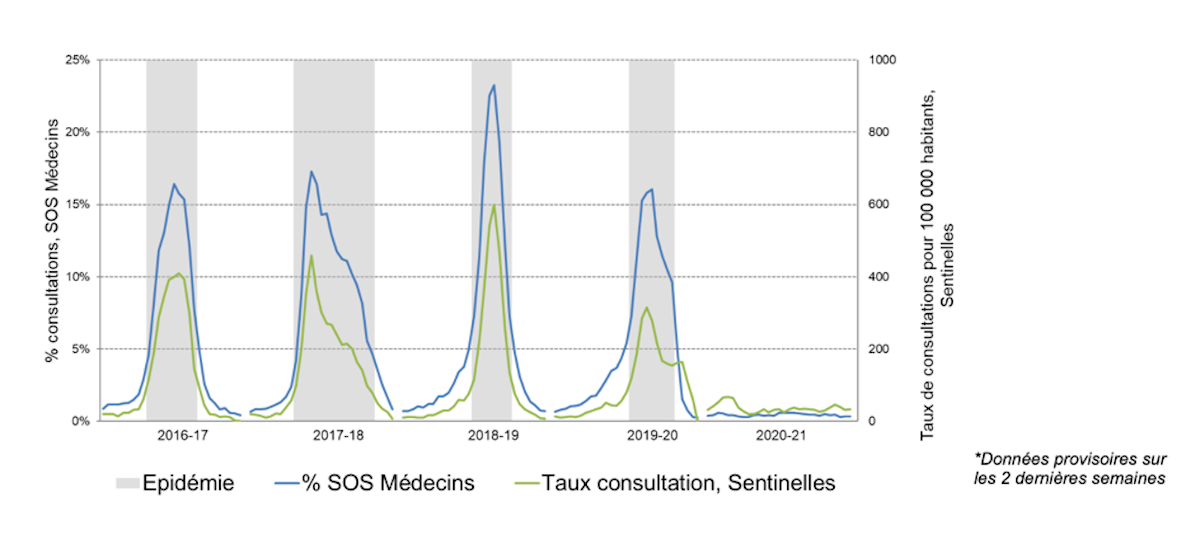
Avec le relâchement des mesures de distanciation liées à la Covid-19, on observe une résurgence des infections respiratoires à virus respiratoire syncytial (VRS) avec un risque significatif sur la santé des nourrissons. Le VRS est, en effet, la 1ère cause d’infections des voies respiratoires inférieures chez les nourrissons, et en particulier de bronchiolite et de pneumonie, et l’une des premières causes d’hospitalisation dans cette population.
Les résultats de l'essai clinique MELODY de phase III, sur 1490 nourrissons peu prématurés ou à terme et en bonne santé, montrent que le nirsevimab a le potentiel de protéger les nourrissons pendant toute la durée de la saison du VRS, avec une seule dose intra-musculaire. Aucune différence cliniquement significative dans les résultats de sécurité n’a été observée entre les groupes nirsevimab et placebo dans le cadre des essais MELODY. Le profil de sécurité global du nirsevimab dans le cadre de l’essai est resté cohérent avec les résultats rapportés antérieurement. L'étude est publiée dans le New England Journal of Medicine.
Une seule injection en préexposition
L’essai a inclus des nourrissons en bonne santé, nés à terme ou peu prématurés (âge gestationnel de 35 SA ou plus), au début de leur première saison du VRS. MELODY a atteint son critère d’évaluation principal, c’est-à-dire une réduction de 74,5% de l’incidence des infections des voies respiratoires inférieures causées par le VRS et nécessitant une prise en charge médicale, comme la bronchiolite ou la pneumonie, par comparaison au placebo (IC à 95% 49,6 à 87,1 ; p<0,001).
Dans le cadre de l’essai MELODY, une réduction numérique du risque d’hospitalisation associée au VRS a été observée, bien que non statistiquement significative : 6 sur 994 nourrissons ont été hospitalisés pour une infection des voies respiratoires inférieures causée par le VRS dans le groupe nirsevimab, contre 8 sur 496 enfants du groupe placebo (62,1%, IC à 95% : -8,6 à 86,8 ; p=0,07).
Des événements indésirables graves ont été signalés chez 67 des 987 nourrissons (6,8%) ayant reçu du nirsevimab et chez 36 des 491 nourrissons (7,3%) ayant reçu le placebo.
Des résultats cohérents avec les études antérieures
Une analyse groupée pré-spécifiée des hospitalisations liées au VRS recensées dans le cadre des essais de phase III et de phase IIb a également été réalisée. Pour les nourrissons à terme et prématurés (âge gestationnel supérieur à 28 semaines), la dose proposée de nirsevimab a permis d’obtenir une efficacité de 77,3% en termes de prévention des hospitalisations associées au VRS (IC à 95% 50,3 à 89,7, p<0,001).
La sécurité et la tolérance du nirsevimab comparées à celle du palivizumab avaient été évaluées dans le cadre d’un essai de phase II/III qui a démontré que le nirsevimab présentait le même profil de sécurité et de tolérance que le palivizumab lorsqu’il était administré à des nourrissons présentant une cardiopathie congénitale, une pneumopathie chronique ou nés prématurément (âge gestationnel de 35 semaines ou moins), au début de leur première saison du VRS.
Parmi les nourrissons dont les données étaient disponibles jusqu'au jour 361, des anticorps anti-médicament ont été détectés chez 58 des 951 (6,1%) dans le groupe nirsevimab et chez 5 des 473 (1,1%) dans le groupe placebo.
Une large étude de phase III
MELODY est un essai multicentrique de phase III, randomisé, contrôlé versus placebo, visant à déterminer l’incidence des infections des voies respiratoires inférieures nécessitant une prise en charge médicale causées par le VRS (confirmées par réaction en chaîne par polymérase après transcription inverse) pendant 150 jours post-dose, comparativement à un placebo, chez des nourrissons en bonne santé au début de la première saison de circulation du VRS de leur vie.
Des nourrissons peu prématurés et à terme en bonne santé (âge gestationnel de 35 semaines ou plus) ont été randomisés (selon un rapport 2/1) pour recevoir une dose unique de 50 mg (pour les nourrissons de moins de 5 kg) ou de 100 mg (pour les nourrissons de 5 kg et plus) de nirsevimab ou de placebo, par injection intramusculaire.
Un anticorps monoclonal attendu
Le nirsevimab est un anticorps monoclonal IgG1 kappa humain recombinant qui se lie aux sous-unités F1 et F2 de la protéine de fusion (F) du VRS au niveau d'un épitope hautement conservé et verrouille la protéine F du VRS dans la conformation de préfusion pour bloquer l'entrée du virus dans la cellule hôte.
Il existe un besoin médical non satisfait en matière de protection contre le VRS chez les nourrissons. Il existe actuellement trois approches à différents stades de développement clinique : l'administration directe d'anticorps au nourrisson, l'acquisition passive d'anticorps par la vaccination maternelle pendant la grossesse et la vaccination active des nourrissons.
Le nirsevimab a une plus grande puissance d'inhibition du VRS que le palivizumab dans les modèles de culture cellulaire et les modèles animaux et possède une région Fc conçue pour avoir une demi-vie prolongée in vivo. Une dose unique de nirsevimab administrée avant la saison du VRS a protégé les prématurés en bonne santé (nés à un âge gestationnel de 29 semaines à <35 semaines) contre l'infection des voies respiratoires inférieures associée au VRS avec une efficacité de 70,1 % et un profil de sécurité favorable.
Le nirsevimab, un anticorps monoclonal administré en préexposition contre le VRS et avec une persistance à dose efficace dans le plasma des nourrissons d’au moins 151 jours, semble efficace pour prévenir les infections des voies respiratoires inférieures associées au VRS chez les prématurés et les enfants à terme en bonne santé.