Neurologie
Alzheimer : les anti-amyloïdes bientôt disponibles en France ?
Alors que le dimanche 21 était la journée mondiale de la maladie d’Alzheimer, le processus de mise à disposition de 2 anti-amyloïde progresse.

- fizkes/iStock
Le dimanche 21 septembre est la journée mondiale de la maladie d’Alzheimer, qui concerne 900.000 personnes en France, selon l'Institut national de la santé et de la recherche médicale (Inserm).
Pour l’instant, il n’existe pas de traitement curatif pour cette pathologie, mais la recherche avance. Ces dernières années, trois laboratoires ont développé deux nouveaux traitements prometteurs : le Leqembi (Biogen/Eisai) et le Kisunla (Eli Lilly).
La HAS refuse l'accès précoce au Leqembi
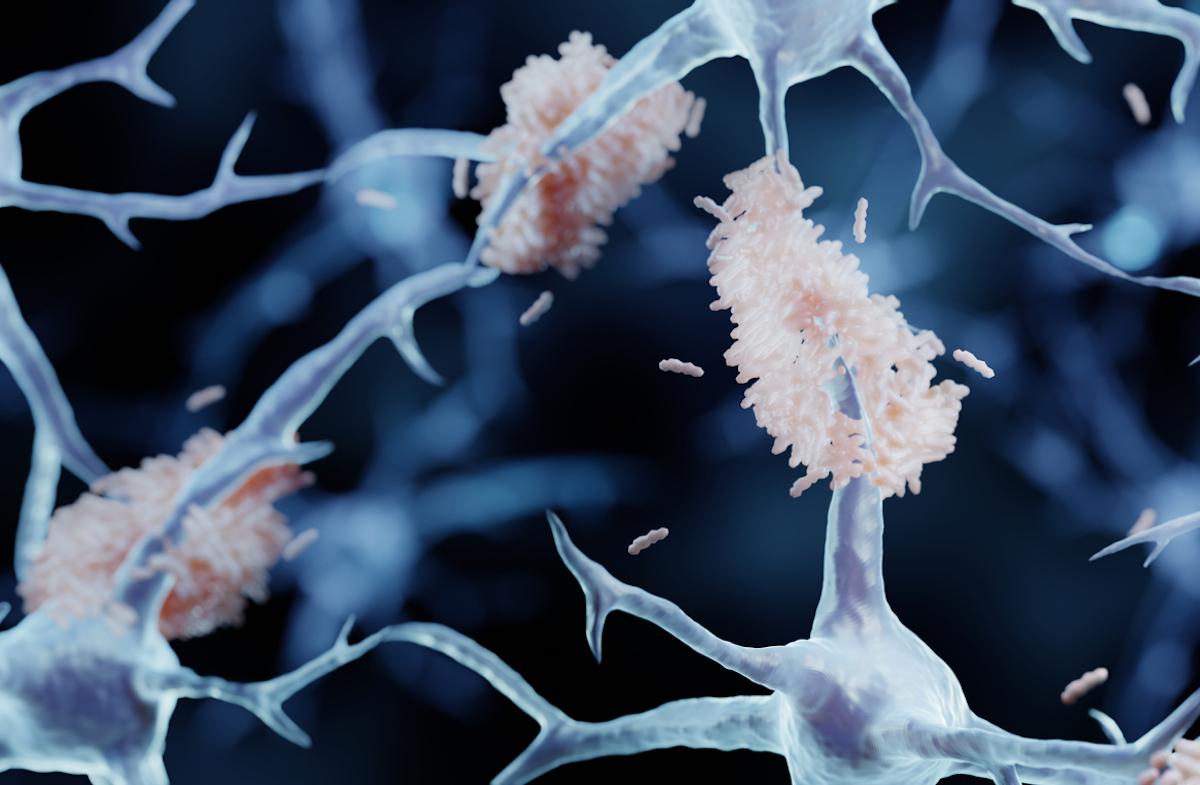
Le premier est le lécanémab, commercialisé sous le nom de Leqembi. Ce traitement, développé par les laboratoires Biogen et Eisai, vise à réduire les plaques amyloïdes dans le cerveau. Ces accumulations toxiques autour des neurones les empêchent de bien fonctionner et contribuent à la perte de mémoire caractéristique d’Alzheimer. Le Leqembi est destiné aux patients qui viennent d’être dépistés et qui en sont aux stades précoces de la maladie.
En juillet 2024, l’Agence européenne des médicaments (EMA) avait rendu un avis négatif pour la mise sur le marché du Leqembi, en raison de risques d’effets secondaires graves. Quatre mois plus tard, l’instance revenait sur sa décision en restreignant l’accès au médicament aux patients présentant un risque faible d’hémorragie cérébrale, c’est-à-dire ceux avec une ou aucune copie du gène ApoE4.
En avril 2025, la Commission européenne avait donné son accord pour une Autorisation de Mise sur le Marché (AMM) du Leqembi. Chaque État membre devait ensuite décider de la commercialisation et du remboursement de celui-ci. En France, le 9 septembre dernier, la Haute Autorité de Santé a rendu un avis négatif sur l'accès précoce à ce médicament, un “dispositif qui permet à des patients en impasse thérapeutique de bénéficier, à titre exceptionnel et temporaire, de certains médicaments non autorisés dans une indication thérapeutique précise”.
Le Kisunla, pas encore autorisé sur le marché européen
Autre médicament récemment développé : le donanemab, commercialisé sous le nom de Kisunla par le laboratoire Eli Lilly. Il vise à ralentir le déclin cognitif chez les patients atteints de la maladie d'Alzheimer aux stades précoces, avec des troubles neurocognitifs légers. Il a obtenu de bons résultats : les participants traités avec ce médicament présentaient un ralentissement du déclin de 36 % sur 18 mois.
Après un premier avis négatif de l’Agence européenne des médicaments (EMA), l’instance est aussi revenue sur sa décision en juillet dernier et a donné son feu vert. Les prochaines étapes sont l’avis de la Commission européenne et, en France, de la HAS. Selon la Fondation Vaincre Alzheimer, le Kisunla est déjà autorisé aux États-Unis, au Royaume-Uni, au Japon, en Chine et en Australie.