Rhumatologie
Sarcome synovial : le blocage de la voie SUMO2 ouvre une piste thérapeutique ciblée
Dans le sarcome synovial, un cancer rare mais agressif, une nouvelle étude montre que l'utilisation d'un médicament bloqueur de la protéine SUMO2 réduit l’expression de la fusion oncogénique SS18::SSX et freine la croissance tumorale, suggérant une option thérapeutique innovante.

- SewcreamStudio/istock
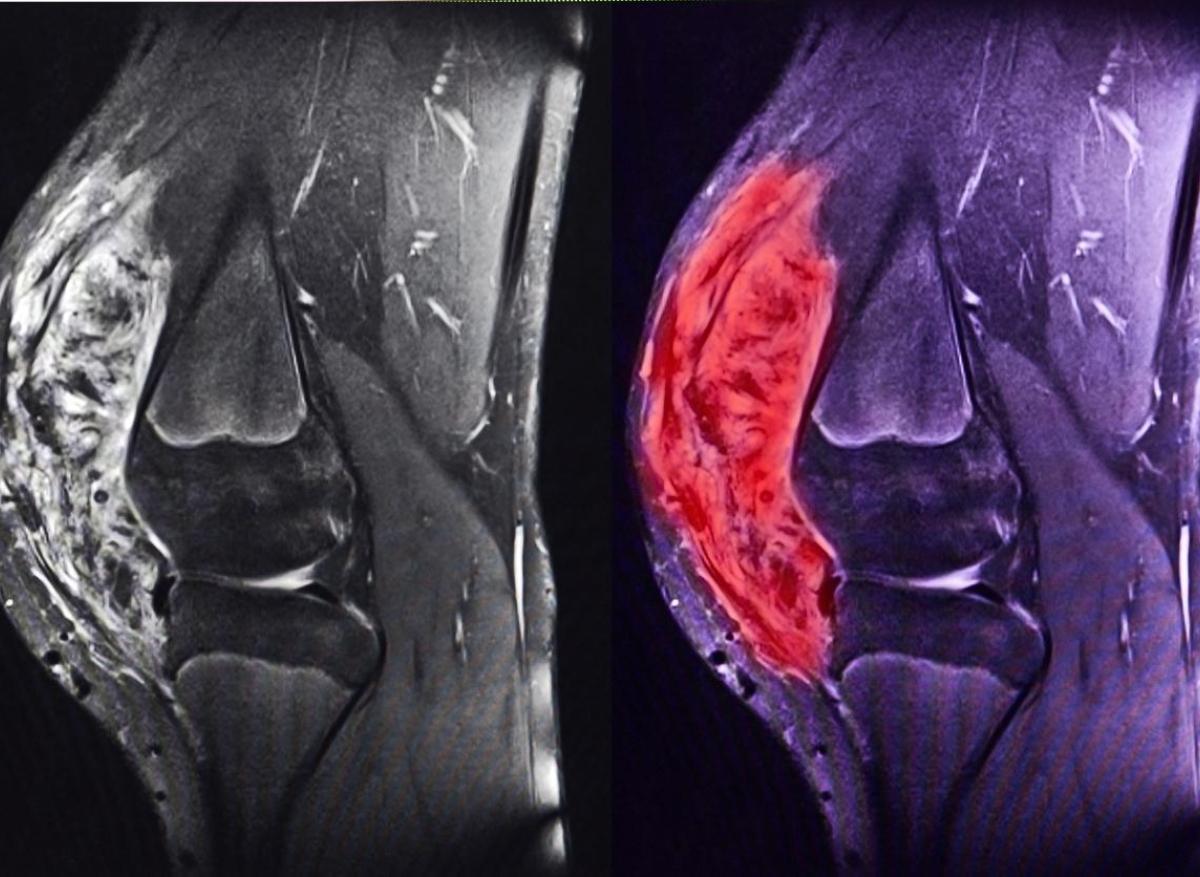
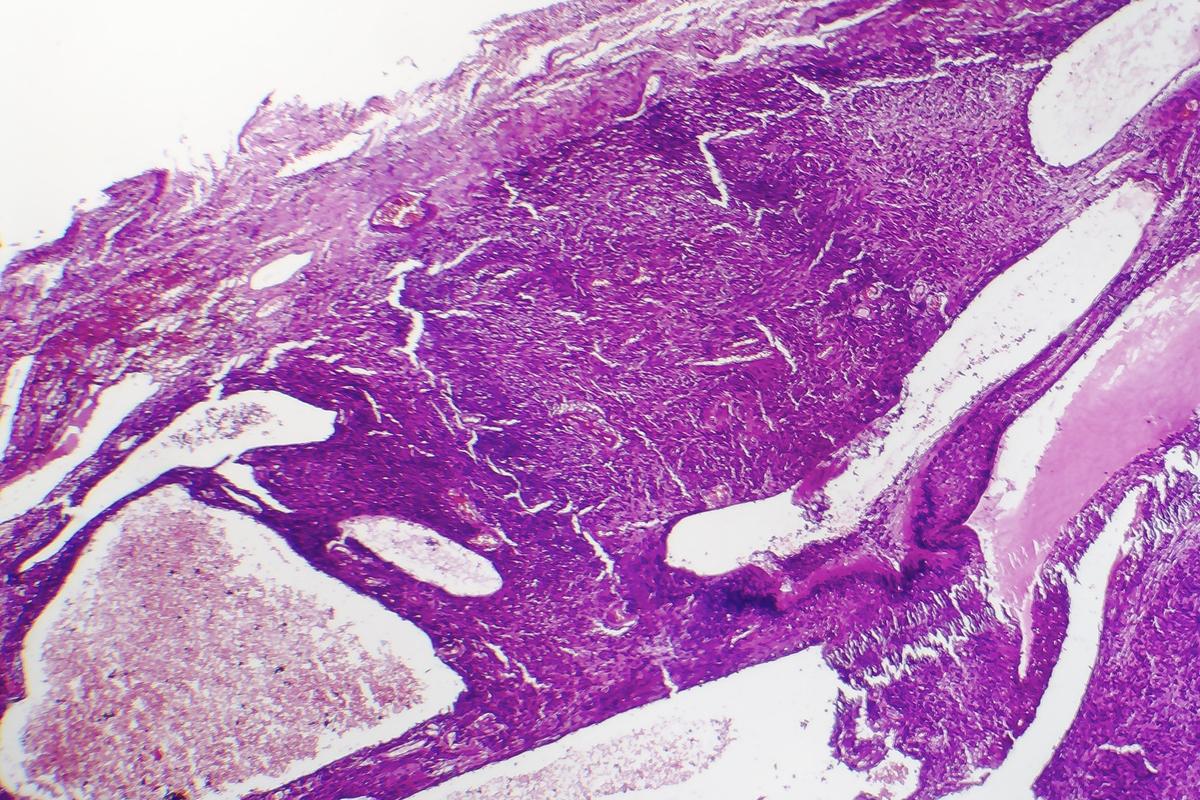
Le sarcome synovial est une tumeur des tissus mous qui touche préférentiellement l’adolescent et l’adulte jeune, représentant 5 à 10 % des sarcomes. Il est caractérisé par la translocation spécifique t(X;18) générant la protéine de fusion SS18::SSX, moteur principal de la tumorigenèse. Cette fusion entraîne un remodelage chromatinien pathologique impliquant les complexes BAF et Polycomb, activant des voies oncogéniques (Wnt/β-caténine, FGFR, NOTCH) et réprimant des gènes suppresseurs. Faute de thérapie ciblant ce mécanisme, le traitement repose encore sur la chirurgie et la chimiothérapie, avec une survie à 5 ans limitée à 50–60 % en cas de métastases.
Pour identifier des vulnérabilités exploitables sur ces cellules, une équipe de recherche a exploité les bases de données génomiques du Cancer Dependency Map et réalisé des cribles CRISPR et RNAi spécifiques. La protéine SUMO2 est apparu comme l’une des vulnérabilités les plus marquées. Son inhibition par TAK-981, un bloqueur de l’enzyme d’activation de SUMO2 déjà évalué dans d’autres cancers, réduit la viabilité cellulaire in vitro et la croissance tumorale in vivo. L’étude est publiée dans EBMO Journal.
Des résultats convergents et robustes
Dans les lignées de sarcome synovial, la déplétion de SUMO2 par édition génétique ou par inhibition pharmacologique entraîne une baisse globale de l’expression de la protéine de fusion SS18::SSX et de son occupation chromatinienne, associée à une diminution de la marque épigénétique H2AK119ub et à une réversion du programme transcriptionnel tumoral. TAK-981 réduit significativement la croissance cellulaire et la capacité de formation de colonies, tout en inhibant la progression tumorale chez la souris. Ces effets n’étaient pas observés dans d’autres lignées tumorales, confirmant la sélectivité du mécanisme.
Sur le plan moléculaire, l’inhibition de SUMO2 permet d’inverser plusieurs voies dérégulées par SS18::SSX, notamment la répression de gènes suppresseurs et l’activation de voies prolifératives. Les auteurs soulignent par ailleurs que l’association potentielle de cette stratégie avec une chimiothérapie conventionnelle pourrait renforcer son efficacité, comme le suggèrent des données précliniques issues d’autres modèles tumoraux. La tolérance du TAK-981 dans les modèles animaux s’est révélée acceptable, sans toxicités majeures limitant l’interprétation des résultats.
Une approche fondée sur les données génomiques à grande échelle
Ces conclusions reposent sur une approche intégrée combinant analyses de dépendances génétiques issues du DepMap, cribles CRISPR/RNAi spécifiques et validation fonctionnelle sur modèles cellulaires et murins. L’étude inclut plus de 17 000 participants dans les bases de données de référence, mais les validations in vivo concernent des modèles expérimentaux limités au sarcome synovial, ce qui restreint la généralisation des résultats. Néanmoins, la cohérence entre les cribles indépendants, les analyses transcriptomiques et l’efficacité pharmacologique confère une robustesse notable à l’identification de SUMO2 comme dépendance critique.
Selon les auteurs, cette découverte suggère une future option thérapeutique ciblée pour une maladie orpheline de solutions innovantes, particulièrement dans les formes métastatiques où le pronostic reste sombre. Les perspectives de recherche incluent l’évaluation clinique du TAK-981 seul ou en combinaison, ainsi que l’exploration de la voie SUMO2 comme biomarqueur de sensibilité. Cette avancée illustre l’intérêt des grandes bases de données fonctionnelles pour accélérer la médecine de précision dans les cancers rares.