Cardiologie
Rétrécissement aortique sévère : TAVI et chirurgie au coude à coude à 7 ans
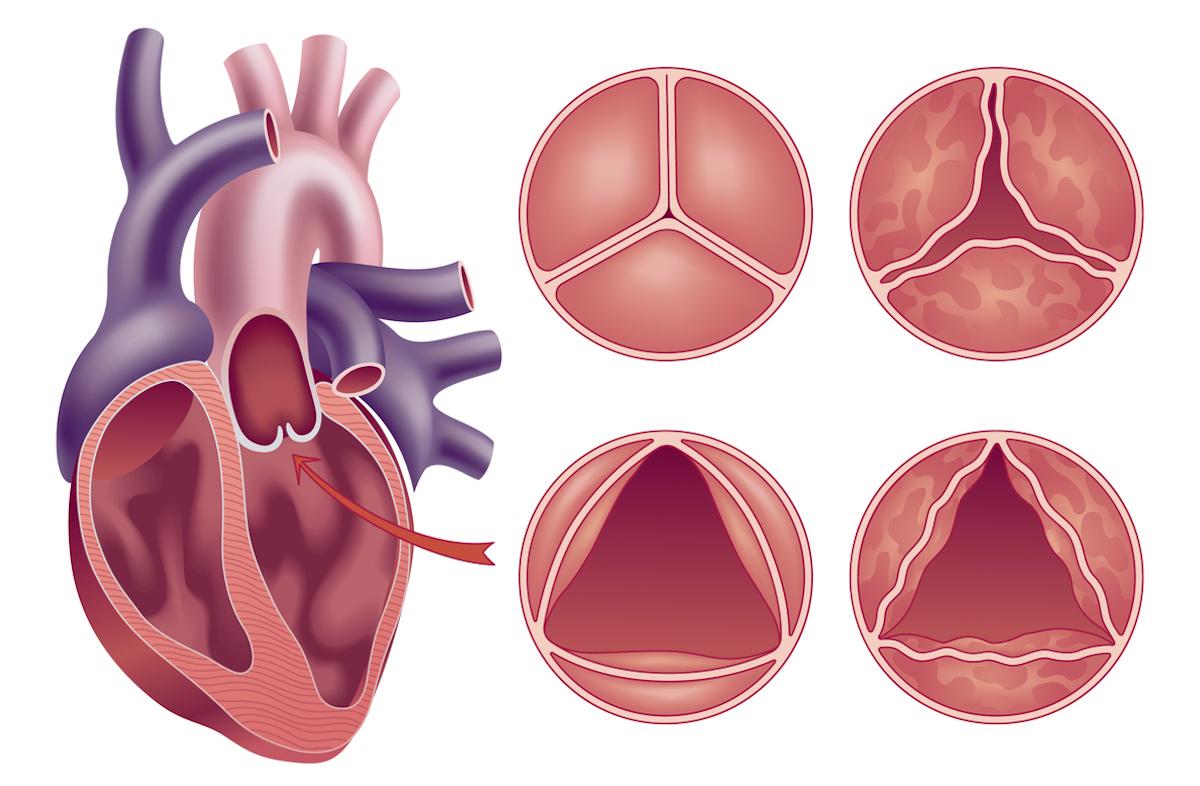
Chez des patients avec rétrécissement aortique sévère et à bas risque opératoire, la stratégie par TAVI transfémoral et le remplacement valvulaire aortique chirurgical montrent, à 7 ans, des résultats cliniques et de durabilité semblables même si certains profils d’événements divergent au long cours.
- asikkk/istock
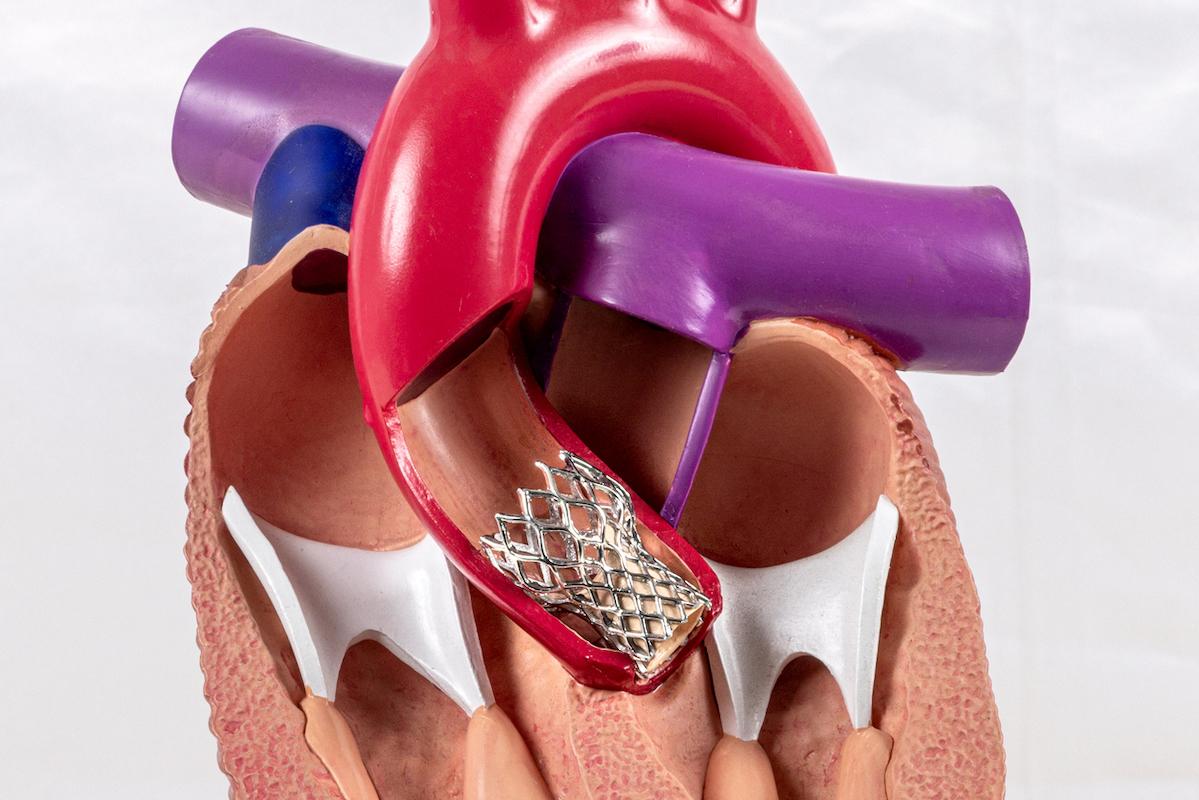
Le TAVI s’est imposé comme alternative à la chirurgie pour la sténose aortique symptomatique, avec des essais randomisés montrant, jusqu’à 5 ans, une non-infériorité voire une supériorité selon le risque. La question déterminante, chez des patients plus jeunes et à bas risque, reste la durabilité des bioprothèses TAVI et le profil d’événements au-delà de 5 ans. L’étude PARTNER 3, présentée au congrès annuel Transcatheter Cardiovascular Therapeutics et dont les résultats sont publiés dans le New England Journal of Medicine, apporte une réponse à 7 ans.
Chez 1000 patients randomisés TAVI transfémoral vs chirurgie, le critère primaire non hiérarchisé (décès, AVC ou réhospitalisation liée au geste, à la valve ou à l’insuffisance cardiaque) est semblable : 34,6 % après TAVI vs 37,2 % après chirurgie (différence −2,6 points ; IC à 95 % −9,0 à 3,7). Le second critère hiérarchisé (win ratio) confirme l’absence de différence (win ratio 1,04 ; IC à 95 % 0,84–1,30). Chez les patients jeune et à bas risque, il ne semble pas y avoir d’écart significatif entre les 2 stratégies à 7 ans.
Efficacité et durabilité à 7 ans : le vrai message du TAVI
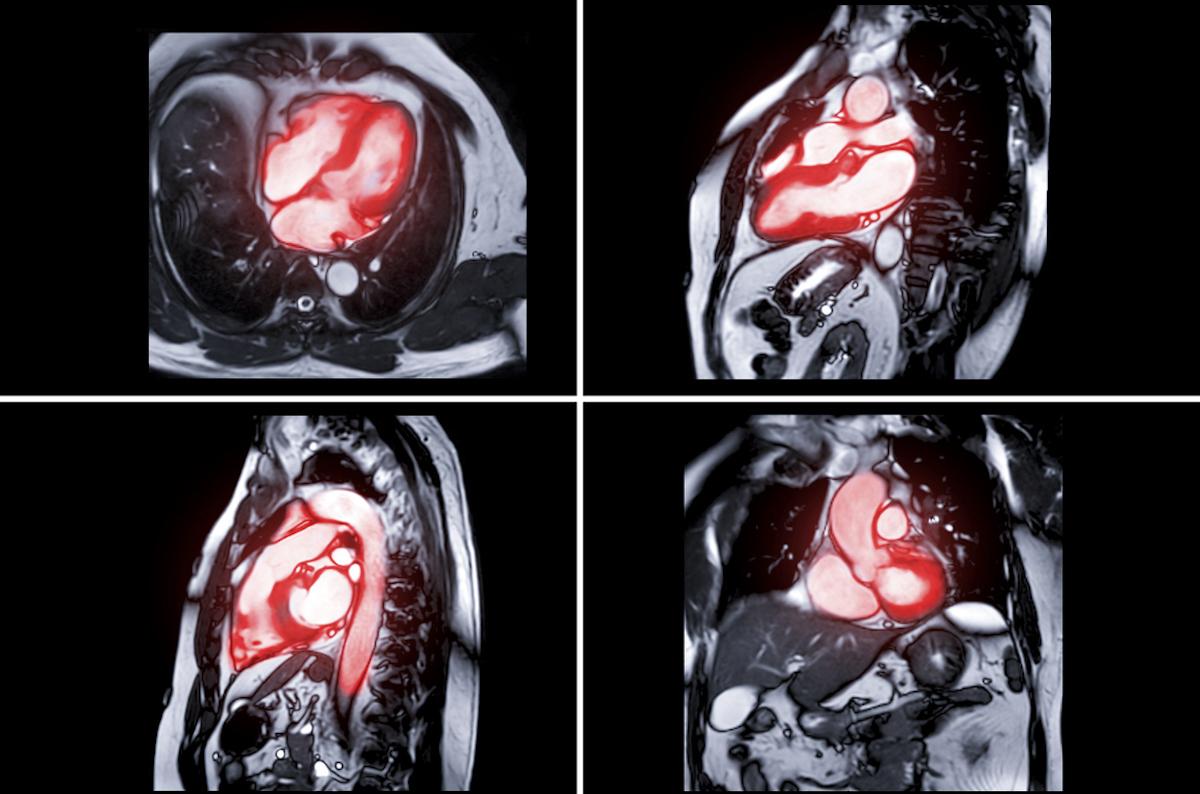
Toutes les composantes du critère primaire restent proches : décès 19,5 % (TAVI) vs 16,8 % (chirurgie) ; AVC 8,5 % vs 8,1 % ; réhospitalisation 20,6 % vs 23,5 %. La durabilité apparaît comparable : défaillance bioprothétique 6,9 % (TAVI) vs 7,3 % (chirurgie), avec des gradients aortiques moyens à 7 ans 13,1±8,5 mmHg vs 12,1±6,3 mmHg et des trajectoires échocardiographiques stables. Les résultats rapportés par les patients sont analogues, la majorité vivante en classe NYHA I–II avec des scores KCCQ-OS > 75.
Le profil d’événements indésirable diffère toutefois : fibrillation atriale de novo moins fréquente après TAVI, tandis que la régurgitation paravalvulaire, la thrombose valvulaire, le bloc de branche gauche et une implantation de pacemaker sont moins fréquents après chirurgie. Entre 5 et 7 ans, on observe plus d’infarctus spontanés et donc de revascularisations après TAVI, contre un excès d’infarctus précoces après chirurgie ; in fine, l’incidence cumulée reste similaire. Les signaux de sécurité tardifs ne s’accompagnent pas d’une dégradation de la durabilité valvulaire à cet horizon.
Au-delà du primaire : les écarts qui comptent pour le patient
PARTNER 3 est un essai randomisé comparant TAVI transfémoral à la chirurgie chez des patients à bas risque, évalué sur 7 ans avec deux critères primaires (composite non hiérarchisé et composite hiérarchisé en win ratio), et un recueil clinique, échocardiographique et de durabilité. L’analyse Kaplan–Meier et l’adjudication centralisée sécurisent l’interprétation, mais plusieurs limites nuancent la généralisabilité : population sélectionnée (accès transfémoral possible, exclusions anatomocliniques), proportion plus élevée de sorties d’étude dans le bras chirurgie, et présence de comorbidités susceptibles d’influer sur les événements tardifs. Les résultats concernent principalement des bioprothèses ballon-dilatées et ne préjugent pas des autres dispositifs.
Selon les auteurs, chez un patient à bas risque, TAVI et chirurgie sont des options équivalentes à 7 ans pour le critère mortalité/AVC/réhospitalisation et pour la durabilité bioprothétique. La décision doit intégrer l’âge biologique, l’anatomie (anneau, coronaires, calcifications), le risque de FA (plutôt chirurgie) vs le risque de conduction/pacemaker et de fuite paravalvulaire (plutôt TAVI), la maladie coronarienne et la stratégie de revascularisation, ainsi que les préférences du patient. Un suivi structuré est donc nécessaire : évaluation clinique et échographique régulière, vigilance vis-à-vis des événements ischémiques tardifs après TAVI et des troubles de conduction après chirurgie.
Ces données confortent une décision partagée orientée par le profil individuel plutôt que par une supériorité intrinsèque d’une technique.