Onco-Sein
Cancer de l’ovaire Platine résistant : une nouvelle option thérapeutique ?
L’utilisation du Mirvetuximab Soravtansine chez les patientes présentant un cancer de l’ovaire platine résistant avec surexpression des récepteurs α aux folates démontre un taux de réponse objective de 32 % et une durée médiane de réponse de 6,9 mois.
- blueringmedia/iStock
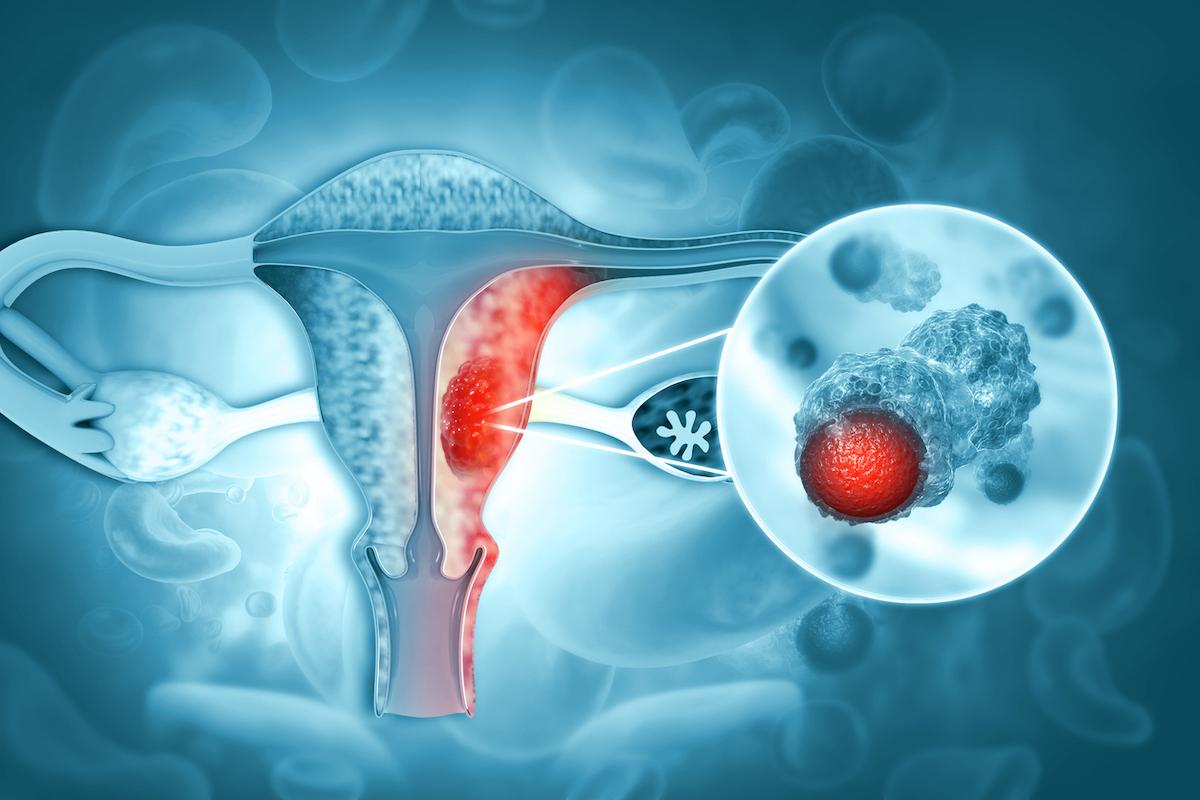
Bien que le panel de molécule thérapeutique actuellement disponible ait dernièrement modifié le pronostic des cancers de l’ovaire, la bascule dans la maladie dite « platine résistante » reste associée à un avenir sombre à court terme. Les perspectives de traitement efficace en terme de bénéfice clinique ou taux de réponse, sont minces. En effet, ces traitements sont constitués d’une succession de lignes de chimiothérapie avec des toxicités cumulatives devenant rapidement limitantes.
Parmi ces tumeurs, plus de 30% vont présenter une surexpression des récepteurs α aux folates. Cette surexpression est le témoin d’une faible chimio sensibilité et questionne sur l’intérêt potentiel d’anticorps drogue conjuguée, dont le Mirvetuximab Soravtansine. Il s’agit d’un traitement combinant un anticorps anti récepteurs α aux folates relié via un linker clivable à une molécule de Ravtansine (DM4).
Étude SORAYA
Publiée récemment dans le Journal of Clinical Oncology par Matulonis et al., l’étude de phase II SORAYA, testant le Mirvetuximab Soravtansine chez les patientes « platine-resistante », retrouve des taux de réponse objective entre 2 et 3 fois plus important que ceux habituellement présents après une chimiothérapie standard dans cette situation, et ce, même chez des patientes lourdement pré traitées (jusqu’à 3 lignes de chimiothérapie préalables).
En pratique, entre Juin 2020 et Mai 2021, 467 patientes présentant un cancer de l’ovaire en phase « platine résistante », déjà pré-traités par une ligne, trois lignes au plus, de chimiothérapie, et obligatoirement par bevacizumab, ont été screenées : 106 patientes présentaient une surexpression des récepteurs α aux folates et ont pu être incluses. Les patientes « platine réfractaire » étaient exclues.
50% des patientes pré traitées par inhibiteur de PARP
Les patientes incluses recevaient une injection de Mirvetuximab Soravtansine 6 mg/kg toutes les 3 semaines, en IV. L’âge médian était de 62 ans, 100 % des patientes présentaient un séreux de haut grade, 59 % de stade III au diagnostic, 20 % avec mutation BRCA connue, 51 % avaient reçu 3 lignes de chimiothérapies antérieures (100 % un sel de platine, 100 % du bévacizumab, 99 % des taxanes, 71 % de la doxorubicine liposomale et 48 % un inhibiteur de PARP). De plus, 60 % des patientes présentaient un intervalle libre sans sel de platine de 3 à 6 mois.
L’objectif principal était le taux de réponse objective, et l’objectif secondaires la durée médiane de réponse, la survie sans progression, la survie globale et la toxicité. Une analyse des sous-groupes en fonction du nombre de lignes thérapeutiques précédentes (un ou deux vs trois), ainsi qu’une exposition préalable aux inhibiteurs de PARP (oui vs non) était prévue.
Haut taux de réponse objective quel que soit le traitement préalable
Après un suivi médian de 13,4 mois, l’exposition au Mirvetuximab Soravtansine dans cette population induit un taux de réponse objective de 32,4 % (IC 95 % ; 23,6-42,2 ; p = 0,0001). Au sein de la cohorte, 5 patientes avec une réponse complète et 29 en réponse partielle. On note une réduction de la taille tumorale chez 71,4 % des patientes. Le taux de contrôle de la maladie était de 51,4 %.
Parmi les sous-groupes, le taux de réponse objective était de 35,3 % chez les patientes prés traités par 1 ou 2 lignes de traitement, 30,2 % après 3 lignes, et 38 % chez les patientes prés exposés aux inhibiteurs de PARP vs 27,5 % en leur absence. La durée médiane de réponse était de 6,9 mois (IC 95 %, 5,6-9,7), et de 5,9 mois chez les patientes prés traités par 1 ou 2 lignes de traitement et 7,4 mois après 3 lignes.
Concernant l’exposition préalable ou non aux inhibiteurs de PARP, la durée médiane de réponse était respectivement de 5,7 et 6,4 mois. La médiane de survie sans progression était de 4,3 mois et 13,8 mois pour la survie globale.
Des effets secondaires variés
Concernant les toxicités, 86 % des patientes ont présenté des effets secondaires dont 29 % de grade ≥ 3, majoritairement une vision floue (41 % - 6 %), une kératopathie (29 % - 9 %), des nausées (29 % - 0 %). Il y a eu peu de toxicités hématologiques et 18 % de neuropathies périphériques sans aucun grade 3. Enfin, 20 % des patientes ont eu une réduction de posologie, et 9 % une interruption de traitement.
Au final, ces résultats préliminaires, qui seront, on l’espère, appuyés par les résultats de phase III en cours (Mirasol), sont intéressants dans cette population de patientes aux perspectives thérapeutiques actuelles pauvres.