Neurologie
Maladie d’Alzheimer : intensification de la polémique sur les anticorps anti-amyloïde
Des chercheurs, impliqués dans la commission consultative de la FDA sur l’agrément et le remboursement de l’aducanunab, l’anticorps anti-amyloïde de Biogen, ont démissionnés et mettent publiquement en cause la forme du débat public sur ce traitement.
- selvanegra/istock
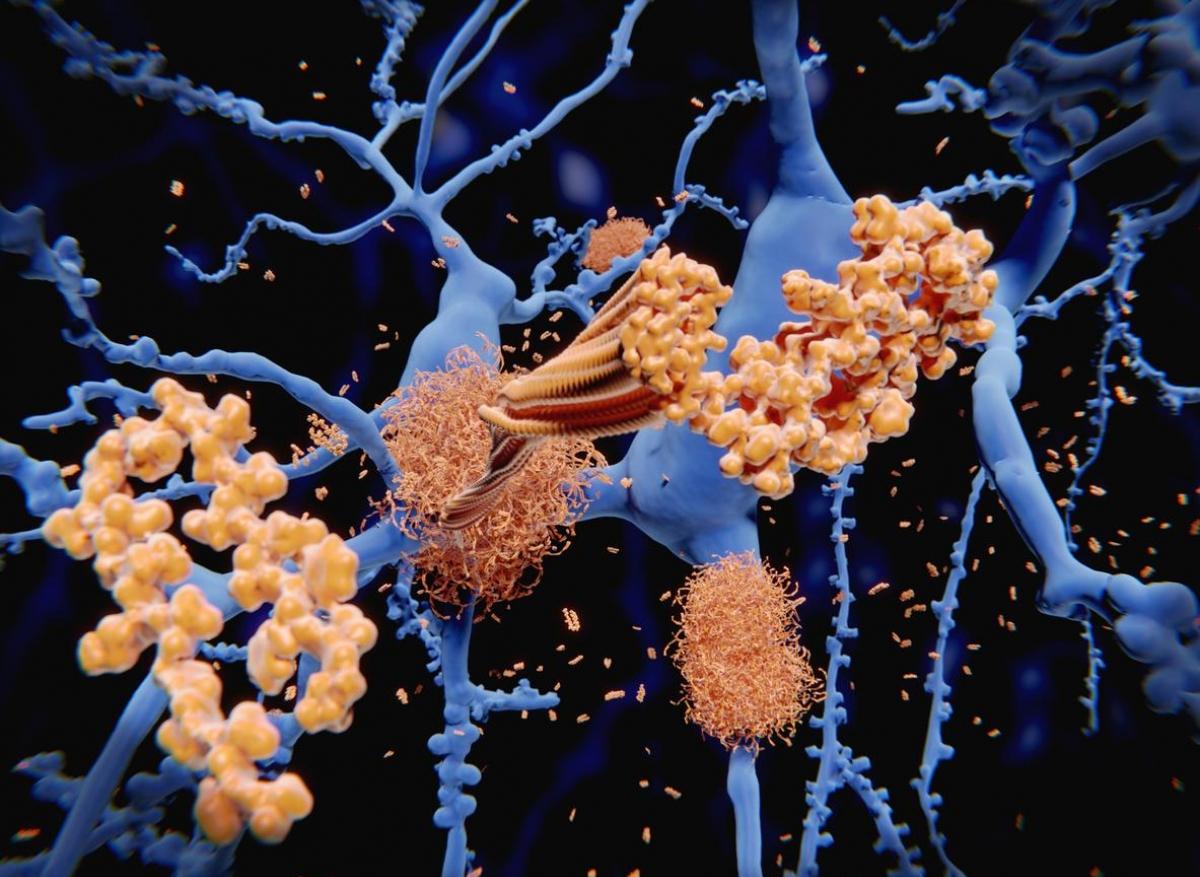
La FDA a accordé en juin l’approbation dans la maladie d’Alzheimer de l’aducanunab, l’anticorps anti-amyloïde de Biogen. Une décision qui ne se fait pas sans grincements de dents pour un traitement qui a jusqu’ici démontré son efficacité principalement sur un « surrogate marker » : la diminution des plaques d’amyloïde dans le cerveau, ou « charge amyloïde », alors que les bénéfices cliniques, s'ils sont statistiquement significatifs, sont aussi cliniquement plus douteux.
Dans un article de CNN, une longue analyse de ce dossier est réalisée alors que plusieurs des chercheurs impliqués dans la commission consultative de la FDA ont démissionnés et parlent de « décision d’approbation la plus mauvaise de la FDA dans l’histoire récente de la maladie d’Alzheimer ».
A noter qu’il s’agit cependant d’une AMM conditionnelle de la FDA concernant uniquement les formes les plus précoces de la maladie : la FDA a demandé au laboratoire Biogen de poursuivre les essais cliniques post-autorisation afin de vérifier les bénéfices cliniques réels sur les fonctions cognitives de la stratégie consistant à cibler les plaques amyloïdes dans le cerveau.
Des études peu convaincantes
Plusieurs études ont été réalisées sur cet anticorps anti-amyloïde de Biogen, l’adunacunab, dans la maladie d’Alzheimer. Certaines ont même été interrompues de façon prématurée en l’absence de bénéfice pour les malades ou en raison de la fréquence d’un œdème cérébral qui serait observé chez près d’un tiers des malades avec des céphalées. Une étude a révélé un bénéfice sur la charge amyloïde et un bénéfice clinique plus discret.
En se fondant sur des résultats positifs concernant surtout un « surrogate marker », la commission consultative a recommandé à la quasi-unanimité de ne pas approuver ce traitement dans la maladie d’Alzheimer (un expert s’est abstenu). La FDA, qui n’est pas obligée de suivre l’avis de la commission consultative (mais les suit dans plus de 8 cas sur 10), a accordé l’approbation de cette molécule et ce serait, selon CNN, en raison de « l’importance des besoins non satisfait dans cette maladie qui reste orpheline de tout traitement ». Donc sous la pression des associations de malades...
Des enjeux financiers considérables
Les enjeux financiers de l’approbation d’une molécule dont le coût annuel serait de 56 000 dollars, et qui pourrait intéresser 6 millions de formes précoces de la maladie aux Etats-Unis, sont colossaux. En particulier pour le gouvernement car, dans ce pays de la libre entreprise, la majorité des personnes de plus de 65 ans sont prises en charge par le Medicare, c’est-à-dire sur des fonds fédéraux.
Le Pr Aaron Kesselheim, l’un des experts démissionnaires, a une perception encore plus péjorative en évoquant un alignement trop fort de la FDA sur les positions de Biogen, en particulier au cours d’une réunion qui a été réalisée en distanciel pendant la pandémie : alors que les experts se concentraient sur le bénéfice clinique, c’est le bénéfice sur la charge amyloïde qui intéressait la FDA... ou les malades.
La théorie historique de la cascade amyloïde
Certes la physiopathologie de la maladie d’Alzheimer a longtemps été basée sur l’hypothèse de la « cascade amyloïde » : la multiplication de ces plaques accompagnant une dégradation de la performance cognitive. Mais, la plupart des stratégies qui ont été mises en place pour réduire la charge amyloïde, quelle que soit la méthode, sont restées sans bénéfice clinique majeur. Désormais, cette théorie est remise en cause. Ce n’est en tout cas certainement pas aussi clair que le lien entre LDL-cholestérol et maladies cardiovasculaires.
La commission consultative avait donc souligné le fait que les dépôts de protéine amyloïde dans le cerveau étaient peut-être plus un marqueur de la maladie qu’un élément actif du processus physiopathologique et avait concentré de ce fait son analyse sur l’effet clinique.
Une histoire qui fait des vagues
Selon un autre expert de la maladie d’Alzheimer, repris par CNN : « La justification d’une approbation à partir d’un effet sur un biomarqueur et en l'absence d'un bénéfice clinique cliniquement significatif après 18 mois de traitement est indéfendable ». Une commission sénatoriale a été réunie et un sénateur a demandé la démission de la directrice de la FDA, bien que celle-ci n’ait pas été impliquée dans cette décision.
Une appréciation que ne partage pas l’Alzheimer Association, une association de malades et leurs familles qui désespèrent d’une solution pour cette maladie orpheline. Et c’est sans doute ce qui a beaucoup pesé dans la balance, au nom d'une conception assez libertarienne de la santé aux USA et ailleurs : les malades sont maîtres de leur corps et auraient un droit élargi d’accéder à des traitements encore expérimentaux.
Au final, l’évolution de la recherche qui est désormais rapide dans la maladie d’Alzheimer permettra sans doute de corriger une décision basée sur un bénéfice non cliniquement significatif. D’autres molécules sont en phase de test, dont des anticorps anti-protéine Tau, dont les effets cliniques pourraient être beaucoup plus prometteurs.