Neurologie
Alzheimer : une nouvelle voie de traitement impliquant les astrocytes
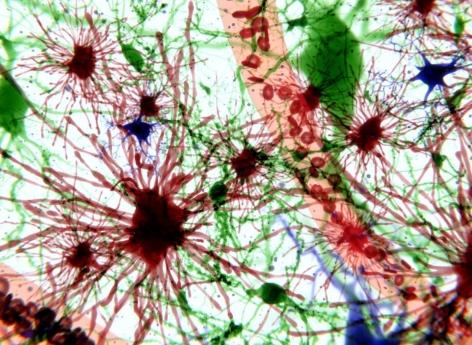
Dans la maladie d’Alzheimer, les astrocytes, qui sont des cellules gliales, c’est-à-dire considérées comme des cellules de support, ont un rôle beaucoup plus actif qu’initialement envisagé dans la survie des neurones.
- selvanegra/istock
Des chercheurs de l'Institut des neurosciences de l'Université de Barcelone (UBNeuro) ont identifié une stratégie thérapeutique prometteuse, utilisant une classe de cellules gliales, les astrocytes, pour traiter la maladie d'Alzheimer. C’est ce qui ressort d’une étude passionnante publiée dans le Journal of Neuroscience.
L'étude montre, dans un modèle de maladie d’Alzheimer chez la souris, que les astrocytes, un type de cellules gliales de forme étoilée, considérées comme des cellules de support et retrouvés naturellement dans le cerveau et la moelle épinière, seraient capables de libérer des protéines favorisant la survie des neurones.
Ces résultats, obtenus dans un modèle de maladie chez la souris, sont une preuve supplémentaire de l’importance des interactions étroites qui existent entre neurones et astrocytes. Ils constituent un pas en avant dans la compréhension du rôle des astrocytes, et ils offrent la possibilité d'utiliser ce type de cellules gliales de manière thérapeutique pour traiter la maladie d'Alzheimer.
Stratégie prometteuse mais complexe
La maladie d'Alzheimer est la forme de démence la plus répandue dans la population. La dégénérescence des cellules nerveuses (neurones), observée chez les patients atteints de cette maladie, provoque des troubles de la mémoire et d'autres fonctions cognitives, parfois associées à des symptômes tels que des troubles de l'humeur et des changements de personnalité.
L’un des traitements les plus prometteurs contre la maladie d'Alzheimer est l'utilisation de facteurs neurotrophiques, une famille de protéines favorisant la survie des neurones, tels que le Brain-Derived Neurotrophic Factor (ou BDNF). Cependant, l’administration de BDNF est compliquée par différents problèmes, tels que le manque de contrôle de sa libération, l’absence de possibilité de le diriger spécifiquement vers le tissu malade et de libérer la quantité appropriée. Or, c’est un problème critique car des doses élevées de BDNF peuvent être neurotoxiques.
Une neuro-inflammation
Dans cette étude, les chercheurs ont étudié le BDNF produit par les astrocytes, dont le fonctionnement est perturbé par la neuro-inflammation liée à la maladie d'Alzheimer. Cette inflammation du tissu nerveux cérébral est responsable d’une altération du fonctionnement de la protéine astrocytaire fibrillaire gliale (GFAP) et son gène codant.
Dans ce contexte, les chercheurs ont conçu un modèle expérimental dans lequel des souris génétiquement modifiées, souffrent de la maladie d'Alzheimer et produisent la protéine BDNF en fonction du taux de GFAP. « Avec ce modèle, à partir du moment où la neuro-inflammation et la pathologie apparaissent, les astrocytes pourraient sur-produire du BDNF uniquement dans les zones les plus touchées du cerveau malade. Par conséquent, ce sont les réactions locales du cerveau qui réguleraient l'administration de BDNF en fonction de la gravité de la maladie », selon Albert Giralt, l’un des chercheurs de l’étude.
Formation de neurones et la plasticité
L'étude montre que cette méthode rétablirait la production et la libération de la neurotrophine dans le tissu neuronal malade au début de la pathologie. Ensuite, le BDNF produit par les astrocytes régule la formation de neurones dans des échantillons de cultures neuronales in vitro et a des effets cognitifs dans des modèles de souris transgéniques.
« Ces résultats montrent pour la première fois que les astrocytes, jusqu’ici considérés jusqu'à présent comme de simples cellules supports des neurones, peuvent produire du BDNF et disposent ainsi des mécanismes moléculaires nécessaires pour le libérer dans les zones où le tissu est malade et qui nécessitent une activité favorisant la survie neuronale », explique Albert Giralt.
Les astrocytes décident de la survie neuronale
Les chercheurs ont également noté que « la singularité de la conception de l'expérience permettait aux cellules astrogliales de décider quand, où et en quelle quantité produire et donner du BDNF à des zones du cerveau altérées ». Par conséquent, « les caractéristiques génétiques du malade peuvent influer de manière endogène et autorégulée la dose et les autres dynamiques thérapeutiques nécessaires pour un traitement personnalisé ».
Bien que l'utilisation de ce traitement soit encore loin d'être possible chez l'homme, les chercheurs remarquent que l'utilisation d'astrocytes constitués à partir de cellules souches pluripotentes induites pourrait être une stratégie thérapeutique prometteuse à explorer.
D'autres maladies neurodégénératives
« Une des possibilités serait de détourner les cellules souches induites de la peau des patients, puis de les modifier génétiquement in vitro pour qu’elles expriment le BDNF sous le contrôle du promoteur GFAP. La dernière étape serait de les différencier et de les déplacer dans les zones du cerveau les plus altérées des malades pour améliorer la survie et le bon fonctionnement des neurones qui restent, note Albert Giralt.
Cette étude qui considère l’impact des processus de neuro-inflammation permet de l’appliquer à d'autres maladies neurodégénératives. « Notre objectif est, d'une part, de rendre cette approche thérapeutique plausible pour une utilisation chez l'homme, et d'autre part, de présenter des approches similaires pour les maladies neurodégénératives dans lesquelles la neuro-inflammation est le principal symptôme », conclut le chercheur.


-1549536999.jpg)