Oncologie
Docétaxel : "Le rapport bénéfice/risque n'est plus favorable"
Selon l'ANSM, 48 patients sont décédés depuis la commercialisation du docétaxel. L'usage de la molécule reste suspendue dans le cancer du sein. L'oncologue lyonnais, Thomas Bachelot explique pourquoi certains centres ont tardé à stopper l'usage du médicament.
- zlikovec/Epictura
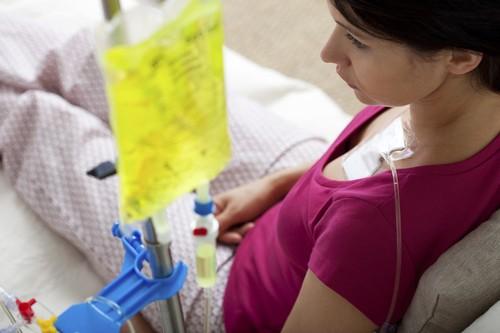
Depuis sa commercialisation en 1996, le docétaxel aurait causé la mort de 48 patients atteints de cancer, selon l’enquête nationale de pharmacovigilance diligentée par l’Agence nationale de sécurité du médicament (ANSM). Cet anti-cancéreux utilisé en combinaison dans de nombreux cancers (sein, prostate, poumon...) fait l’objet d’une enquête depuis septembre 2016, à la suite de signalements d’effets secondaire graves ayant entraîné la mort. Entre août 2016 et février 2017, 5 femmes souffrant d’un cancer du sein sont décédées. Elles ont succombé à des entérocolites provoquées par le docétaxel.
Ces complications étaient connues par les cancérologues et les autorités sanitaires. Mais la multiplication des cas a provoqué un vent de panique ces dernières semaines. Pour autant, l’ANSM se veut rassurante. « Les cas d’effets indésirables de type colite ou choc septique sont rares dans toutes les indications », indique l’enquête précisant qu’ils apparaissent majoritairement dans les 2 semaines suivant l’administration du produit.
En plus de 20 ans, 187 cas de colites ou de chocs septiques ont été rapportés, dont 48 ont conduit à un décès. « Les décès restent rares (de l’ordre de 1/10 000) pour un médicament qui a permis de réduire la mortalité dans de très nombreux cancers », ajoute-t-elle.
L’ANSM prévoit de poursuivre ces travaux pour identifier tous les effets indésirables du docétaxel (princeps et génériques), ainsi que ceux du paclitaxel, une alternative au docétaxel dans le traitement du cancer du sein précoce. En attendant, elle réitère les recommandations de l’Institut national du cancer émises en janvier 2017 indiquant qu’il faut éviter son utilisation chez les femmes atteintes d’un cancer du sein opérable. Une prudence adoptée au Centre Léon Bérard (Lyon) bien que peu de cas graves, explique le Dr Thomas Bachelot.
Avez-vous constaté une hausse des effets indésirables graves avec le générique du docétaxel ?
Dr Thomas Bachelot : Dans notre centre nous ne l’avons pas noté. Nous avons eu des effets secondaires graves régulièrement mais à une fréquence connue avec ce médicament. J’ai eu deux cas de suite à un an d’intervalle, tous les deux avec le Taxotère (la forme princeps, ndlr). Une patiente a perdu son côlon puis une autre est décédée en 2015. La hausse des effets graves a récemment été observée dans les centres parisiens à l’Institut Gustave Roussy et l’Institut Curie.
Il y a deux possibilités. Soit ces accidents sont liés effectivement au générique qui entraînerait plus d’accidents, soit c’est simplement de la malchance. Le générique est utilisé depuis 2012 pour les centres anti-cancéreux. Si vous passez d’une incidence d'incidents de 1 pour 1000 à 5 pour 1000 vous avez effectivement 5 fois plus de risques, mais celui-ci reste très faible. Donc avec un peu de chance, vous avez peu d’accidents, mais il y en a plus dans le centre d’à côté.
L’ANSM avait-elle eu connaissance de ces complications ?
Dr Thomas Bachelot : L’ANSM est au courant de ces problèmes de toxicité du Taxotère car ils sont décrits dans le Vidal et la littérature scientifique. Tant que les incidences de ces toxicités correspondaient à ce qui était attendu, l’agence n’a pas pris de mesures particulières. Je la comprends puisque ce sont des aléas thérapeutiques qui étaient connus. Donc on ne peut pas reprocher à l’ANSM de ne pas avoir pris de position plus stringentes tant que nous n’étions pas arrivés à la situation de l’été dernier où il y a eu une multiplication des accidents qui sont apparus en particulier à Gustave Roussy et l'Institut Curie.
Ecoutez l'intégralité de l'entretien du Dr Thomas Bachelot :
Certains centres ont arrêté d’utiliser le docétaxel dès l’été 2016. Pourquoi avoir attendu février 2017 ?
Dr Thomas Bachelot : Les équipes de Gustave Roussy ont été traumatisées parce qu’elles ont eu deux décès coup sur coup. C’est extrêmement choquant d’avoir un accident comme cela. C’est comme un accident de la route. Du coup les équipes médicales et infirmières de l’IGR se sont senties obligées de l’arrêter. Mais en fait d’un point de vue médical tant que nous n’avions pas le sentiment qu’il y avait une augmentation des incidences et que cela pouvait être considéré comme un aléa thérapeutique, on s’est dit que cela ne valait pas la peine de l’arrêter.
En plus les principaux protocoles de chimiothérapie que l’on utilise ont été décrits avec le Taxotère et pas une autre molécule. Donc en l’arrêtant, on peut se dire qu’on fait courir moins de risque à nos patientes à court terme, mais on risque de leur en faire prendre à long terme. Ce ne sont pas des maladies anodines que l’on traite. On donne ce traitement pour diminuer le risque de rechute du cancer du sein et de mort par cancer. Il faut donc trouver le juste milieu entre le risque et le bénéfice.
Nous avons été confronté à un autre problème : les alternatives n’ont pas été validées dans les protocoles de chimiothérapies adjuvantes du cancer du sein les plus utilisées. Mais quand il y a eu de nouveaux accidents et que l’ANSM a lancé cette alerte, on s’est dit que cela n’était pas raisonnable de continuer et qu’il y avait peut-être un problème avec ces nouveaux génériques. Le rapport bénéfice/risque n’était plus valable pour nos patients. Comme on ne sait pas très bien ce qui se passe, on a préféré changer de molécule.