Cardiologie
Fébuxostat et goutte : pas d’augmentation du risque d’évènements cardiovasculaires
Chez les patients traités pour une goutte, le fébuxostat ne donne pas plus d’événements cardiovasculaires que l’allopurinol, selon l’étude FAST, menée à la demande des autorités européennes.
- Bacsica/istock
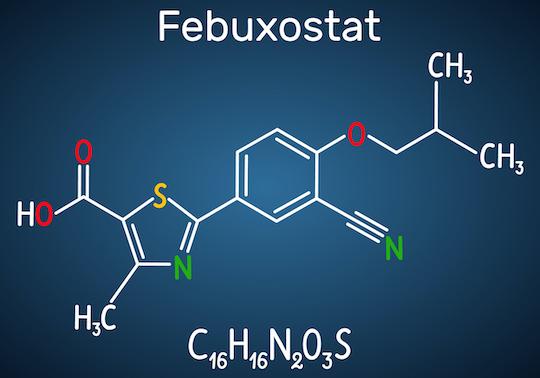
La sécurité cardiovasculaire du fébuxostat, puissant hypouricémiant utilisé dans le traitement de la goutte, fait l’objet d’interrogations depuis les premiers essais cliniques qui l’avaient comparé à l’autre traitement largement utilisé dans ce contexte, l’allopurinol.
Le fébuxostat avait toutefois été mis sur le marché aux Etats-Unis après les résultats d’une étude complémentaire (CONFIRMS), qui n’avait pas retrouvé de différence quant au risque d’événements cardiovasculaires entre ces deux molécules.
Plus de 6000 patients inclus
Les autorités européennes avaient elles aussi demandé à ce qu’un essai clinique comparant les deux hypo-uricémiants soit menée en Europe. Ce sont les résultats de cette étude FAST qui sont publiés dans le Lancet.
Cet essai de non infériorité, prospectif, en double aveugle a inclus 6128 patients en Suède, au Danemark et au Royaume-Uni entre fin 2011 et début 2018. Ils ont été randomisés pour poursuivre un traitement par l’allopurinol à dose optimisée ou changer pour le fébuxostat, à une dose initiale de 80 mg/j, qui pouvait être augmentée à 120 mg/j pour atteindre la cible thérapeutique préconisée par l’EULAR (uricémie < 6 mg/dL).
Critère primaire d’évaluation combiné
Après un suivi moyen de 4 ans, le fébuxostat s’est révélé non inférieur à l’allopurinol sur le critère primaire d’évaluation, qui combinait les hospitalisations pour infarctus du myocarde non fatal, les syndromes coronaires aigus, les accidents vasculaire cérébraux non fatals et les décès cardiovasculaires : 1,72 événements pour 100 patients-années avec le fébuxostat vs 2,05 événements par patients-années dans le bras allopurinol (HR 0,85, IC 95 % 0,7-1,03, p < 0,0001).
Dans le bras fébuxostat, le taux de décès a été de 7,2% et celui d’effets secondaires sévères de 57,3 %. Ces chiffres ont été respectivement de 8,6% et 59,4% chez les patients traités par allopurinol. Les interruptions de traitement ont été de 32,4 % sous fébuxostat et de 16,5% sous allopurinol.
Divergences avec l’étude CARES
Ces résultats contrastent avec ceux de l’étude de phase 4, CARES, qui avait conclu à un risque accru de mortalité cardiovasculaire et de décès de toutes causes chez les patients ayant reçu le fébuxostat. Ceci avait notamment conduit l’Agence nationale de sécurité du médicament à publier une lettre à destination des professionnels de santé, stipulant que « le traitement par fébuxostat chez des patients présentant une maladie cardiovasculaire majeure préexistante doit être évité, sauf si aucune autre option thérapeutique n'est appropriée ».
Les auteurs de l’étude FAST soulignent toutefois que si le design de ces deux essais sont proches, les profils des patients inclus diffèrent. Tous les patients de CARES avaient une maladie cardiovasculaire établie, contre seulement un tiers dans FAST. Le premier avait inclus des sujets ayant un très mauvais pronostic cardiovasculaire, tandis que le second avait exclus ceux ayant une insuffisance cardiaque de classe III ou IV de la NYHA. CARES avaient inclus des patients nouvellement traités, contrairement à FAST, ce qui peut naturellement avoir un impact sur le risque cardiovasculaire.
Autant de paramètres qui peuvent expliquer les résultats divergents de ces deux essais. Par contre, les doses testées dans FAST sont supérieures à celles testées dans CARES.