Onco-dermatologie
Carcinome de Merkel : quelle place pour l’immunothérapie néoadjuvante?
L’immunothérapie néoadjuvante à la chirurgie pourrait transformer totalement la prise en charge des carcinomes de Merkel.
- Istock/CIPhotos
L’efficacité de l’immunothérapie dans le carcinome de Merkel avancé inopérable a été validée dans le cadre de plusieurs essais thérapeutiques qui ont permis l’obtention d’une AMM en France pour l’Avelumab (anticorps anti-PDL-1) en 2ème ligne ou en cas de contre-indication à la chimiothérapie.
Un effectif faible
L’étude « Neoadjuvant Nivolumab for Patients With Resectable Merkel Cell Carcinoma in the CheckMate 358 Trial » s’est intéressée à la tolérance et efficacité du nivolumab néoadjuvant chez les patients atteins de MCC opérable.
Les patients inclus devaient avoir un MCC stade IIA-IIIB (tumeur de plus de 2 cm, ou bien atteinte ganglionnaire ou métastase en transit), stade IV oligométastatique ou bien stade III récurrent. Ils recevaient 2 injections de 240mg de nivolumab espacées de 15 jours et étaient opérés à J19 (+/-7jours).
L’objectif principal est l’analyse de la tolérance et de la survenue de retard à la prise en charge chirurgicale. Les objectifs secondaires comprennent la réponse pathologique complète (pCR), la réponse radiologique selon RECIST, la survie sans progression RFS, la survie globale OS, l’association en virus/statut PDL1 et efficacité. Entre janvier 2016 et mars 2019, 39 patients étaient traités en multicentrique. L’analyse est réalisée après un suivi médian de 20.3 mois (0.5-39.7 mois). Les caractéristiques complètes des patients sont présentées dans la Table 1.
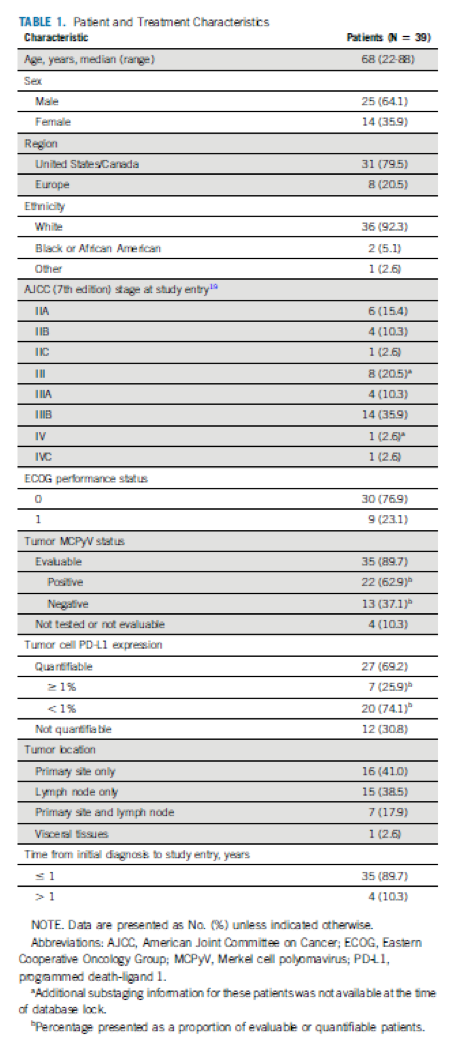
L’âge médian était de 68 ans, la plupart des patients étaient stade III (66.7%). Parmi les 35 patients pour lesquels le statut MCPyV était évaluable, 22 (62.9%) étaient positifs. Parmi les 27 patients pour lesquels l’expression de PDL-1 par les cellules tumorales était mesurable, 7 (25.9%) avaient une expression > ou égal à 1%.
36 patients parmi les 39 traités ont reçu les 2 doses prévues de nivolumab. 3 patients n’ont reçu qu’une dose (un patient avec diplopie binoculaire de grade 2 nécessitant une chirurgie, un patient avec nausée de grade 2 ayant retiré son consentement et un patient pour un rash cutané de grade 3). De plus, parmi ces 39 patients, 3 n’ont pas été opéré tel que protocolairement prévu : un du fait d’une progression tumorale, un ayant retiré son consentement du fait d’une nausée de grade 2 non liée à l’immunothérapie, et un à cause d’une éruption cutanée de grade 3. Concernant l’objectif principal de l’étude, un effet indésirable tout grade confondu est observé chez 46.2% des patients, 3 patient (7.7%) ont un effet indésirable de grade 3-4 et aucun décès lié à une toxicité n’est survenu.
Parmi les 36 patients opérés, le délai médian entre la première administration de nivolumab et la chirurgie est de 4.3 semaines (2.9-15.0 semaines). Il est à noter que la chirurgie est réalisée avec retard au jour 105 chez un patient du fait d’une colite liée au nivolumab.
6 patients sont décédés pendant la période de l’étude, 4 du fait d’une progression de la maladie et 2 d’évènements indésirables non liés au nivolumab.
Un espoir qui reste à confirmer
Une réponse pathologique complète est observée chez 17/36 patients (47.2%). Le taux de réponse pathologique complète et partielle est de 61.5%.
Chez 33 patients, une évaluation radiologique est disponible avec un taux de réponse de 87.9%. 18 patients (54.5%) ont une réduction tumorale > ou égal à 30%. La figure 1 illustre les modifications en taille des tumeurs en fonction de leur statut MCPyV et PDL1.
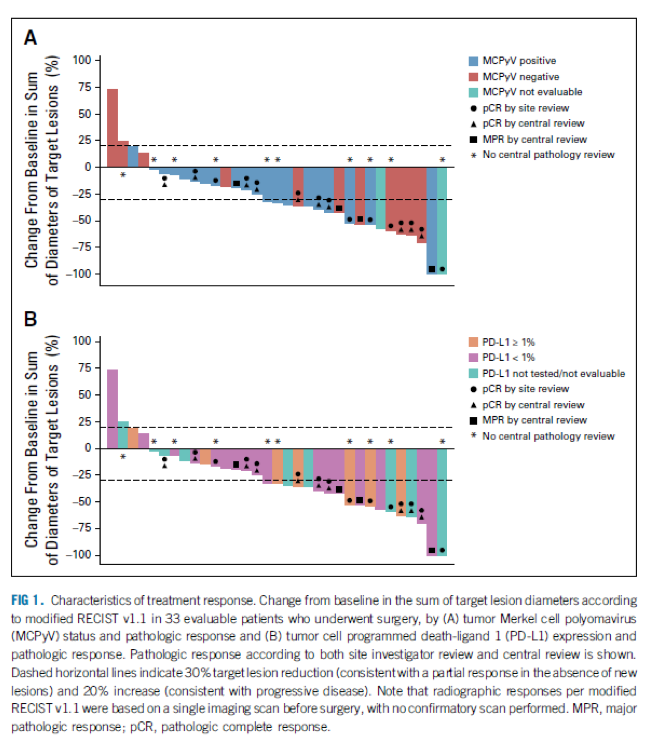
La réponse, dans les limites du faible effectif ne semble pas corrélée à la présence du virus ou l’expression tumorale de PDL1. Il est intéressant de noter que l’évaluation radiologique sous-estime les réponses. Parmi 11 tumeurs pour lesquelles la réduction de taille ne permettait d’atteindre une réponse partielle selon RECIST (<30%), 5 avaient une réponse pathologique complète.
La médiane de survie sans progression n’est pas atteinte chez les 36 patients ayant été opérés. Les taux de survie sans progression (SSP/PFS) après chirurgie sont à 12 et 24 mois de 77.5% (95% CI, 58.4% to 88.7%) et 68.5% (95% CI, 47.5% to 82.6%) respectivement. S’agissant de la survie sans progression chez les patients avec et sans réponse pathologique complète, on observe de façon intéressante une PFS à 12 mois de 100% versus 59.6% et à 24 mois de 88.9 % versus 52.2% (hazard ratio [HR], 0.12 [95% CI, 0.01 to 0.93]).
Chez les patients avec réponse pathologique complète ou réponse pathologique majeure, la survie sans progression à 12 mois est de 100% versus 50% et à 24 mois de 88.9% versus 50% (HR, 0.09 [95% CI, 0.01 to 0.80]). De même il existait une association entre réponse radiologique et survie sans progression. La survie sans progression en cas de réponse >30% versus réponse <30% ou progression était de 100% versus 56.5% à 12 mois et 90.9% versus 48.5% à 24 mois (HR, 0.11 [95% CI, 0.01 to 0.87].
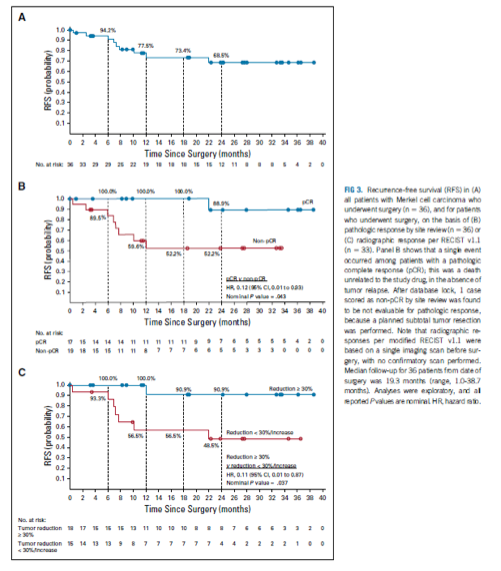
Les courbes de survie sans progression sont présentées dans la figure 2. La médiane de survie globale n’est pas atteinte chez les 39 patients traités. La survie globale à 12 et 24 mois après la première injection de nivolumab est de 93.2% (95%CI, 75.5%to 98.3%) et 79.4% (95%CI, 56.9% to 91.0%) respectivement.
Dans cette étude, le taux de réponse pathologique complète atteint 50% après 2 injection de monothérapie nivolumab. Ce chiffre est très impressionnant et supérieur avec ce qui est observé dans d’autres tumeurs. De plus, la réponse pathologique complète était associée à une meilleure survie sans progression. Le profil de tolérance du nivolumab est comparable à ce qui est déjà connu de cette molécule.
Des stratégies thérapeutiques jusque-là limitées
Le carcinome de Merkel (MCC) est un cancer de la peau touchant les personnes âgées de 75-79 ans en médiane. Une grande partie de ces carcinomes sont associés à l’intégration du virus de Merkel ; Merkel cell polyomavirus (MCPyV) 80%, les autres facteurs de risques sont les ultraviolets et l’immunodépression. Les métastases régionales et viscérale sont fréquentes avec un pronostic sombre dans les formes avancées.
Au stade inopérables, la chimiothérapie était jusqu’à récemment le traitement de référence (association sel de platine et Etoposide) avec des taux de réponse d’environ 60% mais des médianes de survie sans progression faible. En effet, plus de 90% des patients progressaient à 1 an.
Perspectives et conclusion
Les bonnes survies observées chez les patients stade III (comparativement aux survies historiques) sont très encourageantes et laissent penser que la stratégie néoadjuvante dans le carcinome de Merkel est très prometteuse. Ces résultats nécessitent d’être confirmés à plus large échelle et comparés à une stratégie adjuvante
Plusieurs essais d’immunothérapie néoadjuvante dans des cancers solides ont été réalisé, avec notamment dans le mélanome des résultats très intéressants sur la survie sans progression qui serait corrélée avec la réponse pathologique complète.