Hématologie
Leucémie lymphoblastique aiguë à cellules T incurable : l'édition de base ouvre la voie à un traitement révolutionnaire
Une jeune patiente anglaise atteinte d'une leucémie lymphoblastique aiguë à cellules T en rechute a néanmoins guéri après avoir reçu des lymphocytes T modifiés par édition de base dans le cadre d'une thérapie cellulaire qui constitue une première mondiale. Cette technique de transformation des lymphocytes T, qui agit sans cassure de l’ADN, les rend « universels » et ouvre la voie à d’autre thérapies pour les maladies génétiques.
- ttsz/istock
Alyssa, 13 ans, a reçu un diagnostic de leucémie lymphoblastique aiguë à cellules T (T-ALL) en 2021. Elle a été traitée avec tous les traitements conventionnels pour cette leucémie aiguë, y compris la chimiothérapie et une greffe de moelle osseuse, mais malheureusement sa maladie a rechuté et elle était destinée aux soins palliatifs.
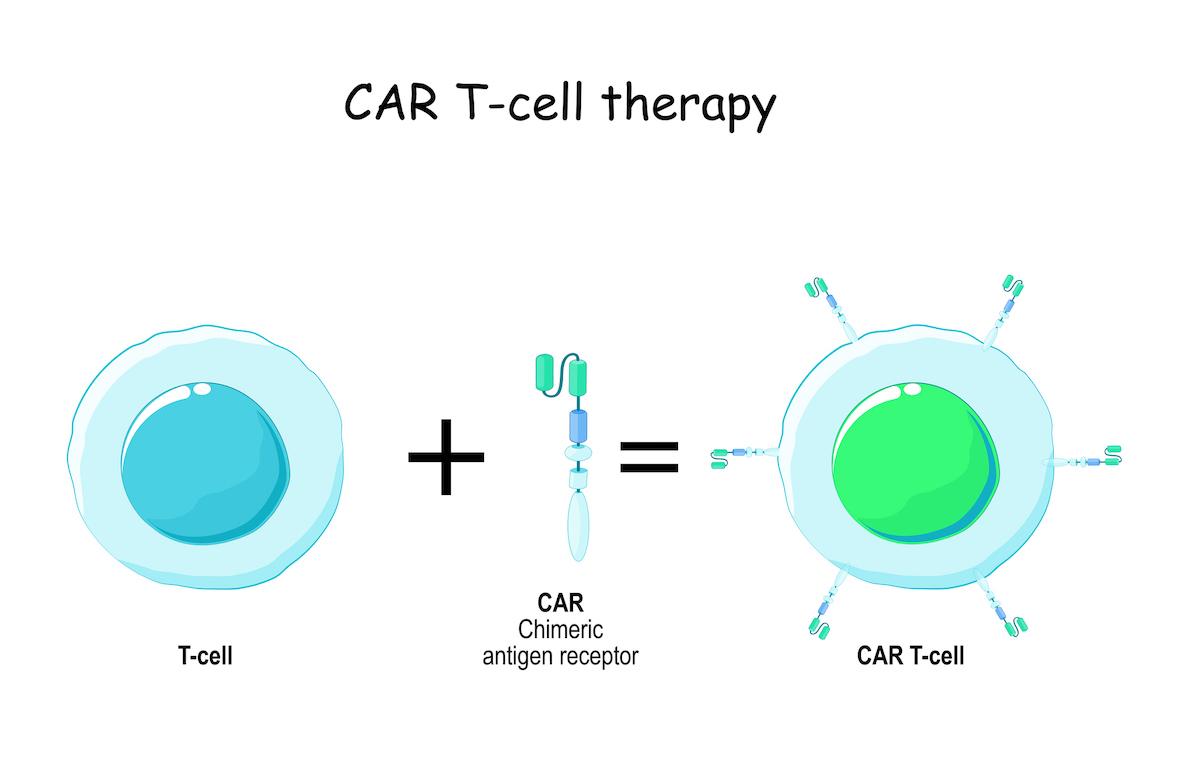
Elle a été la première patiente à participer à l'essai TvT et à recevoir, en mai 2022, des CAR-T cells « universels » qui avaient été fabriqués à partir d'un donneur volontaire sain. Ces lymphocytes ont été modifiées à l'aide d'une nouvelle technologie d'édition de base, sans séparation ni cassure de l’ADN, conçue et développée par une équipe de chercheurs de University College London, dirigée par le professeur Waseem Qasim.
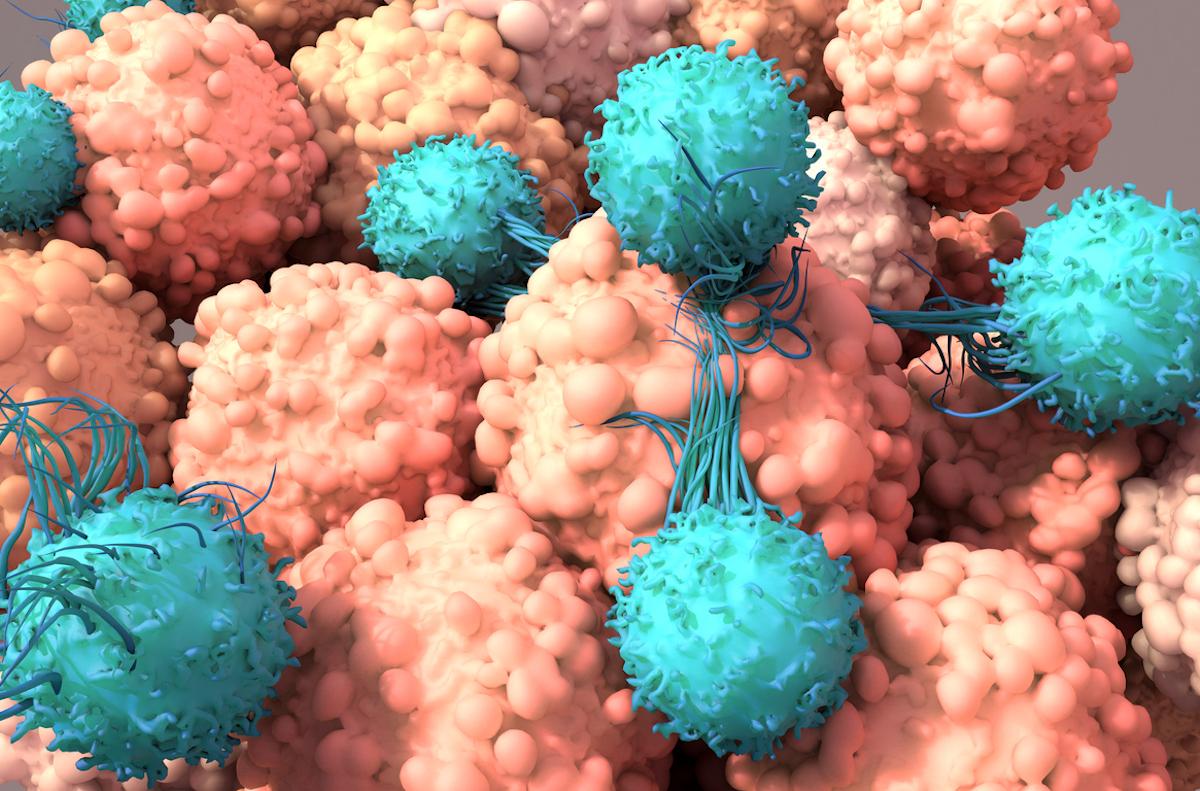
Elle a reçu ces CAR-T cells « universels » qui ont traqué et détruits les lymphocytes T cancéreux sans s'attaquer les uns aux autres. Vingt-huit jours plus tard, Alyssa était en rémission et a bénéficié d'une deuxième greffe de moelle osseuse pour rétablir son système immunitaire. Aujourd'hui, six mois après la greffe de moelle osseuse, elle se porte bien. Ces données ont été présentées lors du congrès annuel 2022 de l'American Society of Haematology à la Nouvelle-Orléans, aux États-Unis.
Un nouveau type de CAR-T cells « universels »
L'utilisation de lymphocytes T modifiées par édition de gène (CAR-T) pour traiter une leucémie à cellules B a été mise en œuvre pour la première fois par la même équipe en 2015 et ils ont récemment fait état d'essais pour les enfants utilisant les techniques traditionnelles CRISPR/Cas9.
Cependant, il a été plus difficile de traiter certains autres types de leucémie de cette manière, car les cellules T conçues pour reconnaître et attaquer les cellules cancéreuses finissent également par s'entretuer au cours du processus de fabrication en laboratoire. De multiples modifications supplémentaires de l'ADN sont donc nécessaires pour générer des banques de CAR T cells anti-T « universels » pour cette étude.
Pour créer ces cellules, des lymphocyte T de donneurs sains ont été modifiés selon une technique « d’édition de base » mise au point il y a moins de 6 mois au Great Ormond Street Hospital, à Leicester, avec quatre changements distincts :
• Suppression des récepteurs existants afin que les lymphocytes T d'un donneur puissent être mis en banque et utilisés sans matching, ce qui les rend « universels ».
• Suppression d'un marqueur de membrane CD7 qui les identifie comme étant des lymphocytes T. Sans cette étape, les lymphocytes T programmés pour tuer les cellules T finiraient simplement par détruire les lymphocytes reprogrammés par un « tir ami ».
• Suppression d'un deuxième marqueur de membrane appelé CD52 qui rend les cellules modifiées invisibles à certains des médicaments administrés au patient au cours du traitement.
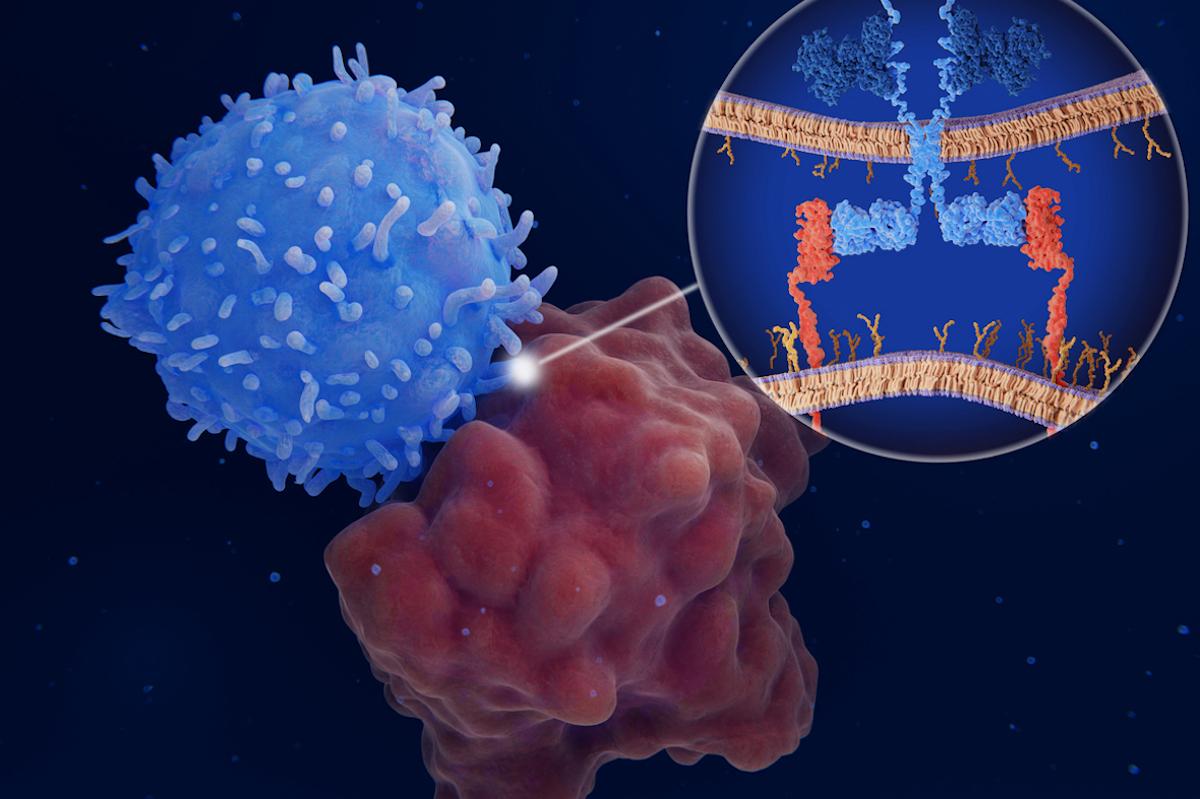
• Ajout d'un récepteur antigénique chimérique (CAR) qui reconnaît le récepteur CD7 des cellules T leucémiques. Les cellules deviennent armées contre le CD7 et reconnaissent et combattent la leucémie lymphoblastique aiguë à cellules T.
Une technique plus précise et plus sûre
Ces modifications ont été obtenues par « édition de base », c'est-à-dire par la conversion chimique de bases nucléotidiques uniques (lettres adenine (A), cytosine (C), guanine (G) and thymine (T) du code de l'ADN) qui portent les instructions pour une protéine spécifique. Par exemple, en remplaçant la cytosine par la thymine dans le gène de la CD7, on crée un « codon stop » qui empêche la machinerie cellulaire de lire les instructions complètes et la production de la CD7 est interrompue.

Copyright Juliette de Noiron/Fréquence Médicale
Il en résulte des CAR-T cells modifiés qui peuvent être administrées au patient afin qu’ils trouvent et détruisent rapidement les lymphocytes T de l'organisme, y compris les lymphocytes T leucémiques. En cas de succès, le patient reçoit alors une greffe de moelle osseuse pour restaurer son système immunitaire épuisé.
Les traitements précédents reposaient sur des techniques appelées TALENS ou CRISPR/Cas9 pour modifier les gènes par des coupures effectuées par des « ciseaux génétiques ». À la différence de CRISPR/Cas9, la nouvelle méthode d'édition de base agit sans provoquer de cassures dans l'ADN, ce qui permet d'effectuer davantage de modifications, avec moins de risques d'effets indésirables sur les chromosomes.
La technique est également étudiée pour tenter de corriger les mutations nuisibles du code génétique dans le cadre de diverses maladies héréditaires.