Neurologie
Gliome grade 2 muté IDH : bénéfice significatif d'un double inhibiteur oral IDH1/2
Le vorasidenib, un double inhibiteur oral des enzymes IDH1/2 mutées, retarde la progression de la maladie ou le décès dans les gliomes de grade 2 avec mutation IDH 1 ou 2, en minimisant les effets invalidants à long terme des traitements actuels.
- Trifonov_Evgeniy/istock
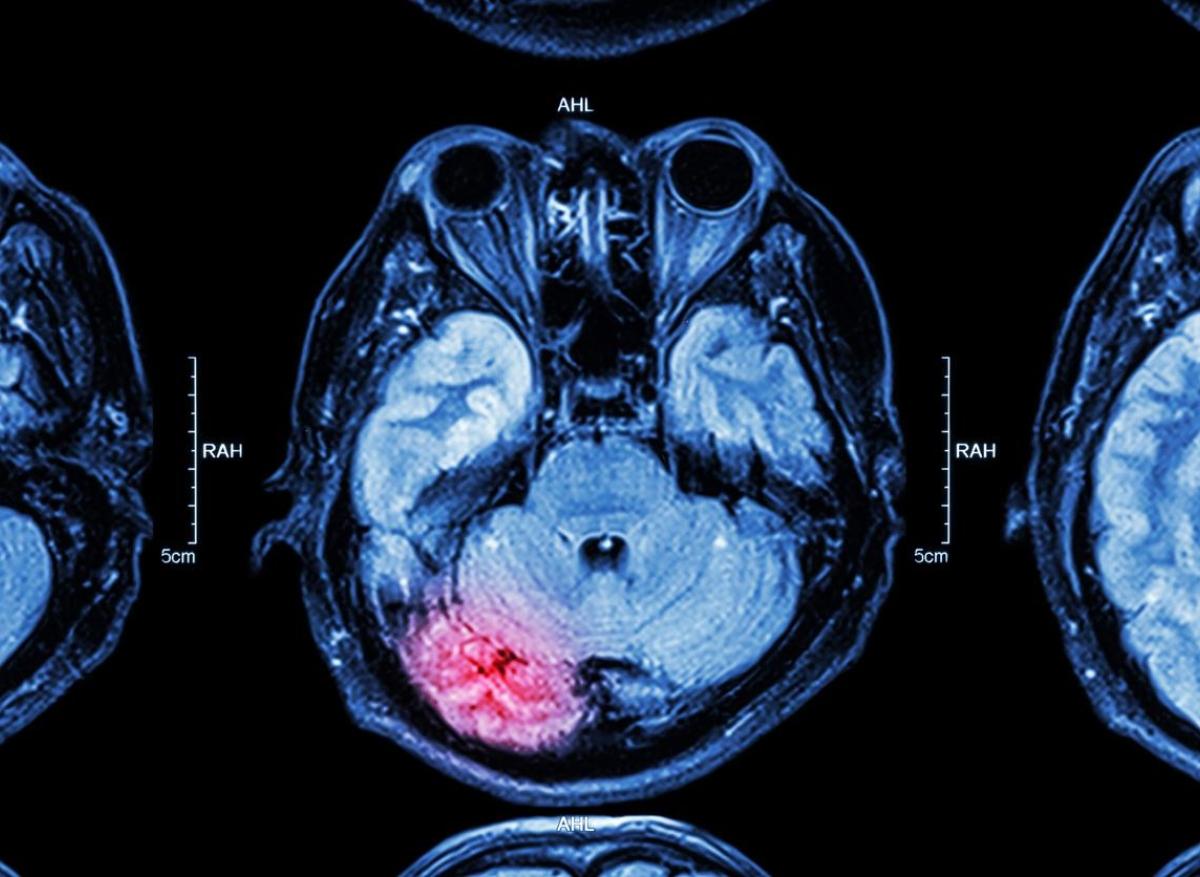
Les gliomes de grade 2 sont des tumeurs cérébrales malignes à progression lente dont le pronostic à long terme est sombre. Les traitements actuels (chirurgie suivie d'une surveillance ou d'une radiochimiothérapie adjuvantes) ne sont pas curatifs et peuvent être associés à des toxicités à court et à long terme. Les mutations de l'isocitrate déshydrogénase (IDH) 1 ou 2 sont présentes dans, respectivement, 80 % et 4 % des gliomes de grade 2 et constituent une caractéristique définissant la maladie dans la définition de l’OMS 2021.
Le vorasidenib, un double inhibiteur oral des enzymes IDH1/2 mutées, améliore de manière significative la survie sans progression chez les patients atteints de gliomes de grade 2. Ce traitement retarde la progression de la maladie et est bien toléré. Ces résultats représentent une avancée significative dans le traitement des gliomes de grade 2 avec mutations IDH. L'étude a été présentée en session plénière du congrès 2023 de l'American Society of Clinical Oncology (ASCO) et publiée conjointement dans le New England Journal of Medicine.
Avancée significative dans le traitement des gliomes
Chez les patients atteints de gliomes de grade 2 IDH mutés, le traitement par vorasidenib montre une amélioration significative de la survie sans progression dans l'étude de phase III INDIGO : la médiane de survie sans progression est de 27,7 mois contre 11,1 mois pour le placebo (HR pour la progression de la maladie ou le décès, 0,39 ; IC à 95 %, 0,27 à 0,56 ; p<0,001). Une amélioration significative du délai avant le prochain traitement est également observée (délai médian avant le prochain traitement non encore atteint, comparé à 17,4 mois pour le placebo (HR, 0,26 ; IC à 95%, 0,15 à 0,43 ; p<0,001).
Le vorasidenib est assez bien toléré avec un profil de sécurité gérable, et des effets secondaires rapportés à la fois dans le groupe placebo et dans le groupe de traitement. Bien qu'il y ait eu des effets indésirables dans le groupe de traitement (fatigue, céphalées, diarrhées, nausées, Covid-19 et élévations réversibles des transaminases hépatiques), la plupart d'entre eux étaient gérables et se sont résorbés avec une surveillance médicale appropriée. L'augmentation de l'enzyme hépatique alanine aminotransférase a été l'effet indésirable de grade ≥3 le plus fréquent, survenant chez 9,6 % des patients recevant le vorasidenib.
Une étude de phase 3 sur plus de 300 malades
Le vorasidenib, un double inhibiteur des enzymes mutées (m)IDH1/2, administré par voie orale et pénétrant dans le cerveau, montre un profil de sécurité tolérable et une activité clinique préliminaire dans les études de phase 1.
Dans cette étude mondiale de phase III, randomisée, en double aveugle, contrôlée versus placebo, 331 patients éligibles (16-71 ans) de 10 pays, atteints de gliomes de grade 2 et de mutations IDH, ont été recrutés. Les patients ont été randomisés pour recevoir une dose orale quotidienne de vorasidenib ou un placebo en cycles de 28 jours, avec 168 patients dans le bras vorasidenib et 163 dans le bras placebo.
Le critère d'évaluation principal est la survie sans progression, sur la base d'IRM cérébrales examinées de manière centralisée. Le principal critère d'évaluation secondaire était le délai avant le prochain traitement. Le passage du placebo au vorasidenib a été autorisé en cas de progression confirmée de la maladie par imagerie.
Le vorasidenib est actuellement évalué en association avec le pembrolizumab dans le cadre d'une étude de phase I en cours sur les gliomes de grade 2/3. De futurs efforts de thérapie combinée rationnelle dans les gliomes de bas et de haut grade sont à l'étude.
Rappel sur la classification des gliomes
Les gliomes sont les tumeurs cérébrales primaires malignes les plus fréquentes chez les adultes et sont classés par l’OMS en sous-types et grades tumoraux distincts en fonction d'une combinaison de caractéristiques histologiques et moléculaires.
Des mutations dans les gènes codant pour les enzymes métaboliques isocitrate déshydrogénase 1 (IDH1) ou 2 (IDH2) sont présentes dans presque tous les gliomes diffus de grade 2 chez l'adulte. L'enzyme mutante produit le métabolite 2-hydroxyglutarate, qui s'accumule dans le tissu gliomateux et inhibe de manière compétitive diverses enzymes dépendantes de l'α-cétoglutarate, ce qui entraîne un large éventail de changements dans l'hydroxyméthylation de l'ADN, l'expression des gènes, la différenciation cellulaire et le microenvironnement tumoral.
Compte tenu de leur pathogénie moléculaire unique, les gliomes qui ont des mutations IDH sont classés comme des entités distinctes dans la dernière mise à jour de la classification de l'OMS. Les gliomes avec une mutation IDH1 ou IDH2 et une translocation déséquilibrée entre les chromosomes 1 et 19 (1p/19q-codeleted) sont définis comme des oligodendrogliomes, tandis que les gliomes IDH-mutants sans codélétion 1p/19q (1p/19q-non-codeleted) sont définis comme des astrocytomes.
Les oligodendrogliomes et astrocytomes mutants IDH de grade 2 se développent continuellement (bien que lentement), infiltrent le tissu cérébral normal et finissent par devenir des tumeurs agressives avec une croissance tumorale et une néovascularisation accélérées, ce qui se traduit par l'apparition d'un rehaussement sur l'imagerie par résonance magnétique (IRM) réalisée avec l'utilisation d'un produit de contraste.