Oncologie
Immunothérapie : peut-on les utiliser au cours des maladies auto-immunes ?
La question de l’utilisation d’une immunothérapie pour traiter un cancer au cours d’une maladie auto-immune devient critique au vu de la fréquence des affections malignes au cours de ces maladies et de l’efficacité de ces traitements.
- Meletios Verras/istock
La survenue de certains cancers au cours d’une maladie auto-immune peut faire discuter une immunothérapie dans les stades avancés. Mais les poussées inflammatoires de certaines maladie auto-immunes ressemblent très fortement à certains effets indésirables auto-immuns des immunothérapies et il y a un mécanisme logique qui relie ces effets à l’immunothérapie, d’où la crainte du déclenchement d’une poussée lors de leur utilisation. A côté de cette crainte légitime, il y a aussi la question de la préservation de l’efficacité de l’immunothérapie dans ce contexte de dysfonctionnement auto-immun et de traitement immunosuppresseur quasi systématique.
Face au risque vital que fait courir le cancer, la crainte d’une poussée évolutive de la maladie auto-immune peut sembler un moindre risque, mais les spécialistes d’organes qui ont été confrontés à des poussées évolutives sévères pensent le contraire. A condition de privilégier une monothérapie et de gérer au plus près les poussées inflammatoires et en collaboration avec les spécialistes d’organe, l’immunothérapie serait pourtant possible.
Immunothérapie et effets indésirables auto-immuns
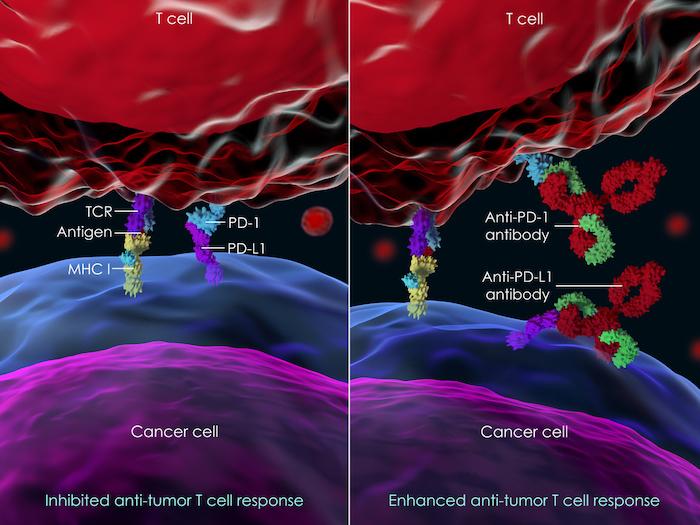
Les immunothérapies, ou inhibiteurs du checkpoint, ont révolutionné le traitement de certains cancers (mélanome, cancer du poumon ou des voies urinaires…). Actuellement, les molécules ciblées par ces traitements sont essentiellement le PD-1/PD-L1 ou le CTLA-4, qui sont des régulateurs de la réponse immunitaire. Ces molécules sont bloquées par le cancer afin de lui permettre d’éviter une réaction immunitaire qui gênerait son développement. Mais, le principal problème vis-à-vis des maladies auto-immunes est que ces régulateurs servent également de soupape de sécurité au système immunitaire et que leur rôle est d’éviter une réaction immunitaire excessive contre les organes du corps telle qu’elle existe au cours d’une affection auto-immune.
Il est d’ailleurs frappant de constater que certains effets indésirables des immunothérapies reproduisent des maladies auto-immunes classiques. Il en est ainsi des colites survenant au cours des immunothérapies qui ressemblent aux MICI, ou d’arthrites qui miment des rhumatismes inflammatoires auto-immuns. Ces effets indésirables de types auto-immuns surviennent sans facteur de risque connu en dehors de l’association anti-PD-1 et anti-CTLA4.
Immunothérapie et maladie auto-immune
Si les immunothérapies sont classiquement contre-indiquées an cas d’antécédents de greffe d’organe, d’immunodépression induite par une infection (de type VIH) ou par un immunosuppresseur, nombreuses sont les interrogations quant à leur utilisation contre un cancer survenant au cours des maladies auto-immunes, comme une polyarthrite rhumatoïde, un lupus, une MICI, une sclérose en plaque…
La crainte de survenue d’une poussée évolutive de la maladie auto-immune est légitime, d’autant plus si cette poussée peut faire courir un risque vital. Or, dans certaines séries, ces malades peuvent représenter jusqu’à 10% des cancers du poumon. Une session de l’ASCO 2019 avait fait un point sur ce problème et nous en retranscrivons ici l’essentiel.
Des données rétrospectives et limitées
On ne dispose d’aucune étude randomisée incluant ce type de malades car ils sont généralement exclus des études. Les seules données dont on dispose proviennent de séries rétrospectives de taille relativement modeste (45 à 85 malades), concernant le mélanome, le cancer du poumon non à petite cellule et le cancer du rein.
Pour les anti-PD-1/PD-L1, les poussées de la maladie auto-immune surviennent dans 23 à 65% des cas, plutôt vers le 40ème jour de l’immunothérapie. Elles concernent essentiellement une aggravation des symptômes habituels de la maladie auto-immune associée, surtout dans les rhumatismes inflammatoires et les maladies auto-immunes cutanées (vitiligo et psoriasis) mais moins pour les maladies auto-immunes digestives ou neurologiques. Les manifestations sont principalement des douleurs articulaires et des manifestations digestives inflammatoires plutôt que de nouveaux symptômes. Celles-ci sont le plus souvent modérées et restent gérables avec un ajustement du traitement de la maladie auto-immune (essentiellement la corticothérapie à une dose relativement faible de 5 à 10 mg par jour), avec un petit nombre d’interruptions de l’anti-PD-1/PD-L1. La réponse du cancer à l’immunothérapie ne semble pas franchement modifiée, que la maladie auto-immune préexiste au cancer ou qu’elle apparaisse après le début de l’immunothérapie, excepté si le traitement immunosupresseur est fortement dosé.
Pour les anti-CTLA4 (ipilimumab), les données disponibles sont moins importantes mais semblent similaires, pour l’essentiel. On ne dispose d’aucune donnée concernant l’utilisation de l’association anti-PD-1/PD-L1 et anti-CTLA4 en cas de cancer et de maladie auto-immune.
Immunothérapie possible sous condition
L’ensemble des données sur le traitement des cancers par immunothérapie au cours d’une maladie auto-immune provient donc d’études de faible niveau de preuve. De plus, pour d’évidentes raisons de prudence, la plupart des études rétrospectives concernent des patients souffrant de maladies auto-immunes modérées et sans risque vital avéré. Il reste donc difficile d’extrapoler ces données aux maladies auto-immunes les plus sévères.
Néanmoins, lors du dernier congrès de l’ASCO, une conférence a fait le point sur cet aspect. Tout en prônant la collaboration entre les oncologues et les spécialistes d’organes qui gèrent ces maladies auto-immunes, la conclusion était qu’il n’y avait pas lieu de priver ces malades du bénéfice des immunothérapies dans les bonnes indications à condition de privilégier les monothérapies et une surveillance attentive.
Au final, en cas de cancer avancé au cours d’une maladie auto-immune, les inhibiteurs du checkpoint sont envisageables dans leurs indications les meilleures sous réserve de privilégier une monothérapie et une surveillance stricte.